Yazar: Deniz Usta
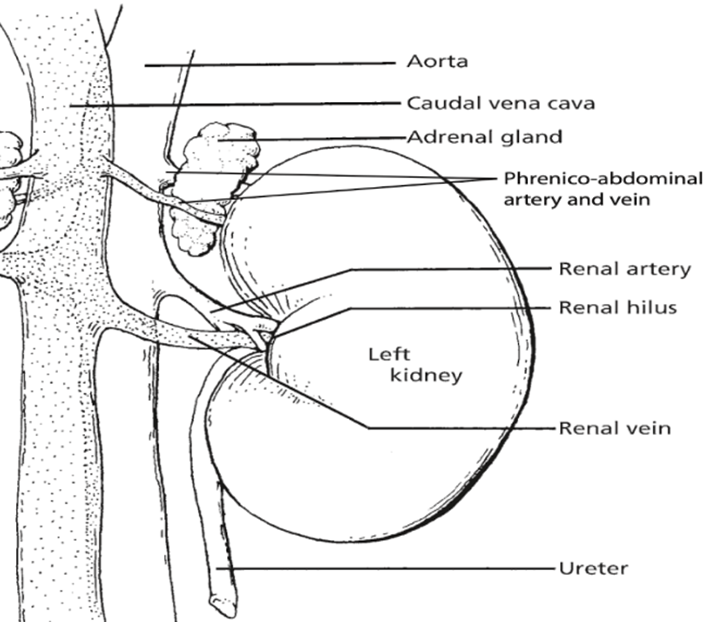
Memeli vücudundaki temel çift organlar olan böbrekler, sağ böbrek sağ kanatta ve sol böbrek sol kanatta olmak üzere, sırt karın bölgesinin her iki tarafında simetrik olarak yer alır.
Bu olağanüstü organlar, kan dolaşımından atık ürün filtreleme gibi çok önemli bir işlevi yerine getirerek vücudun iç ortamının korunmasında çok önemli bir rol oynar. Bu karmaşık süzme işlemi, kan glomerulus olarak bilinen özel bir yapıdan geçerken gerçekleşir. Dikkat çekici bir şekilde, böbreklerin spesifik anatomik konfigürasyonu, farklı türler arasında kayda değer farklılıklar gösterebilir ve bu da hayvanlar alemindeki yaşam formlarının dikkate değer uyarlanabilirliğini ve çeşitliliğini yansıtır.
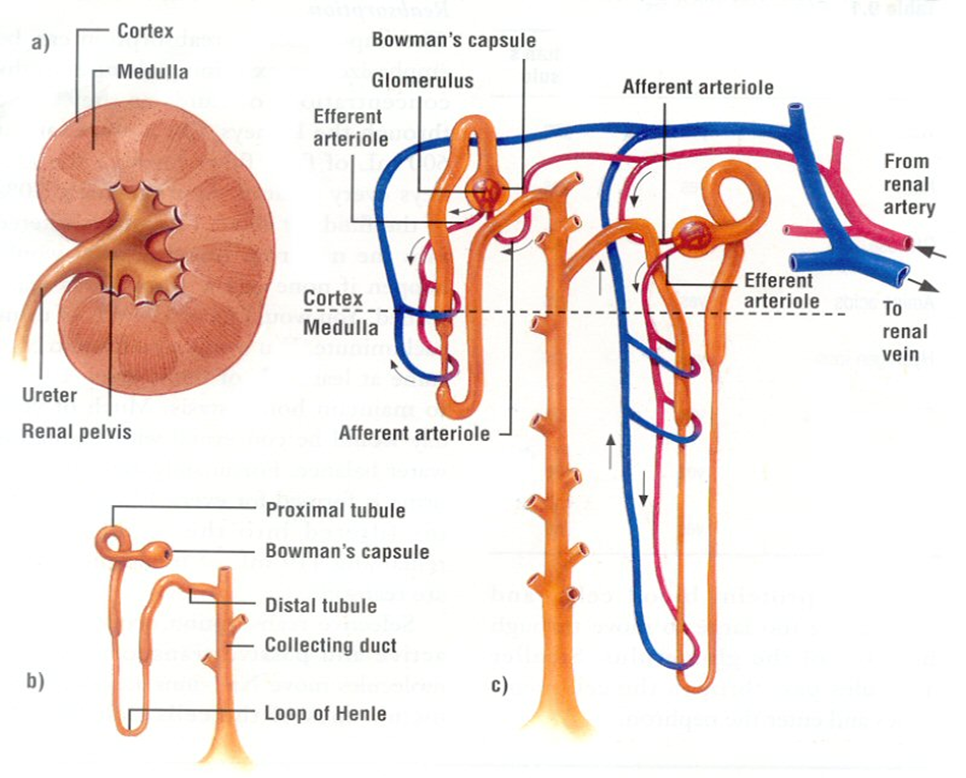
Nefron Birimi
Yapısal ve işlevsel olarak karmaşık bir birim olan nefron, böbreğin fizyolojik operasyonlarının temel yapı taşı olarak hizmet eder. Nefron biyolojisinin ilgi çekici bir yönü de nefronların bolluğundaki türler arası kayda değer çeşitliliktir. Nefronlar genel olarak iki ana kategoride sınıflandırılabilir: kortikal veya kortikomedüller nefronlar ve juxtamedüller nefronlar. Ağırlıklı olarak dış ve orta kortikal bölgelerde bulunan birincisi, glomerüllerin varlığı ile karakterize edilir ve medulla ile korteks arasındaki birleşme noktasına, hatta medullanın dış bölgesine kadar uzanan Henle kulpları ile ilişkilidir. Buna karşılık, juxtamedullary nefronlar, adından da anlaşılacağı gibi, renal korteks içinde medullaya daha yakın konumdadır. Bu nefronlar glomerüller ile de ayırt edilir ve medullanın derinliklerine uzanan Henle kulplarına bağlanır, bazı Henle kulpları renal pelvise kadar ulaşır. Nefron dağılımı ve konfigürasyonundaki bu yapısal çeşitlilik, böbrek sisteminin türler arasındaki dikkat çekici adaptasyon kabiliyetinin altını çizerek, her organizmanın kendine özgü taleplerini karşılamak için fizyolojik işlevlerini hassas bir şekilde ayarlamasına olanak tanır.
Böbrekler, atık filtrasyonundaki rollerinin yanı sıra, kan basıncını, kırmızı kan hücresi üretimini ve mineral metabolizmasını düzenlemek için kritik öneme sahip hormonların salgılanmasına kadar uzanan çok yönlü bir işlev görür. Bu hormonlar, yani renin-anjiyotensin sistemi (RAS), eritropoietin (EPO) ve 1,25-dihidroksi-vitamin D3, bedensel homeostazın çeşitli yönlerini korumak için çok önemlidir.
Renin-anjiyotensin-aldosteron sistemi (RAAS), fizyolojik süreçlerin karmaşık bir etkileşimini düzenler. Vücudun elektrolit dengesini, sıvı dengesini ve kan basıncı regülasyonunu aktif olarak yönetir ve böylece kardiyovasküler sağlıkta hayati bir rol oynar.
Böbrekler tarafından üretilen bir diğer önemli hormon olan Eritropoietin (EPO), vücudun düşük oksijen seviyelerine verdiği yanıtta kilit bir oyuncu olarak görev yapar. Yüksek irtifa gibi durumlarda veya kronik akciğer rahatsızlıkları olan bireylerde EPO, kemik iliğini kırmızı kan hücrelerinin üretimini artırması için uyarır. Böbrekler hipoksiye daha fazla EPO salgılayarak yanıt verir ve kanın oksijen taşıma kapasitesini artırır. Tıbbi uygulamada, EPO genellikle anemiyi gidermek için terapötik bir ajan olarak reçete edilir.
Vücuttaki kalsiyum ve fosfor seviyelerinin korunması 1,25-dihidroksi-vitamin D3 tarafından büyük ölçüde etkilenir. Bu hormon, diyet kaynaklarından kalsiyum ve fosfor emilimini kolaylaştırmak için bağırsakları etkileyerek, kemiklerde kalsiyum birikimini ve emilimini düzenleyerek ve paratiroid hormonunun (PTH) üretimini kontrol ederek birçok cephede etkilerini gösterir. PTH, normal kan kalsiyum seviyelerinin korunmasının ayrılmaz bir parçasıdır ve böbreklerin mineral metabolizmasındaki rolünü daha da vurgular.
Bu hayati işlevleri yerine getirmek için, vücuttaki tüm hücreler gibi böbrek hücreleri de enerjiye ihtiyaç duyar. Aslında böbrekler, sadece kalp tarafından geçilerek en çok enerji gerektiren organlardan biri olarak öne çıkmaktadır. Bu yüksek enerji gereksinimi, önemli mitokondriyal içeriklerine ve oksijen tüketimlerine bağlanmaktadır. Böbrekler yüksek bir dinlenme metabolizma hızına sahiptir ve enerji ihtiyaçlarını karşılamak için bol miktarda mitokondri gerektirir.
Kan dolaşımından alınan glikoz, böbrek hücreleri için birincil enerji kaynağı olarak hizmet eder. Glikoza ek olarak, böbrek hücreleri yağ asitleri ve amino asitler de dahil olmak üzere alternatif enerji substratlarını da kullanabilir. Bu metabolik çok yönlülük, böbreklerin değişen enerji taleplerine uyum sağlaması ve çok yönlü fizyolojik rollerini sürdürmesi için gereklidir.
Glikoz: ATP Sentezi için Temel Yakıt
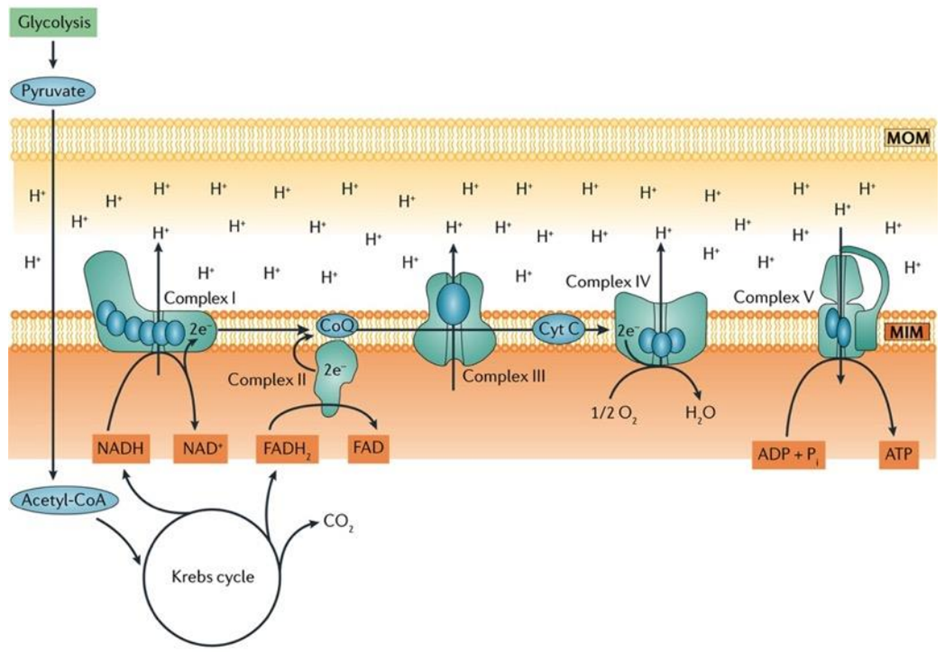
Aerobik solunum, adenozin trifosfat (ATP), su ve karbondioksit (CO2) üretmek için oksijenin titizlikle tüketildiği temel bir hücresel süreçtir. Aerobik solunum sırasında üretilen ATP’nin aslan payı, elektron taşıma zincirinin (ETC) karmaşık işleyişinin ve elektronların bu sistem içindeki sıralı hareketinin doğrudan bir sonucudur. Süreç, aerobik solunumun ilk adımı olan ve temel yakıt olan glikozun piruvata dönüştürülmesini içeren glikoliz ile başlar.
Mitokondriyal matriks içinde, piruvat dehidrojenaz kompleksi piruvatı enzimatik olarak trikarboksilik asit (TCA) döngüsünü besleyen önemli bir substrat olan asetil-CoA’ya dönüştürür. Bu döngü, işlenen her glikoz molekülü için altı molekül nikotinamid adenin dinükleotid (NADH+H+), iki molekül flavin adenin dinükleotid (FADH2) ve altı molekül karbondioksit ve su üretimiyle sonuçlanır.
İç mitokondriyal membranda, ETC’nin kompleks I ve kompleks II’si devreye girerek sırasıyla NADH+H+ ve FADH2‘den türetilen elektronları alır. Bu elektronlar, kompleks IV’e ulaşana kadar bir kompleksten diğerine geçerek elektron taşıma zinciri boyunca karmaşık bir yolculuğa çıkarlar. Kompleks IV’te oksijen son elektron alıcısı olarak görev yapar ve böylece terminal ürün olarak su oluşumunu kolaylaştırır.
Özellikle, iç mitokondriyal membranda bulunan temel bileşenler olan koenzim Q ve sitokrom c, elektronların sırasıyla kompleks I/II’den kompleks III’e ve kompleks III’ten kompleks IV’e aktarılmasına aracılık ederek elektron akışının kesintisiz ilerlemesini sağlamada çok önemli bir rol oynar.
Nihayetinde, adenozin difosfatın (ADP) ATP’ye dönüşümü dinamik bir enzim kompleksi olan ATP sentaz tarafından katalize edilir. Bu enzim, elektron taşıma zinciri tarafından üretilen enerjiyi ATP sentezini yönlendirmek için kullanır ve Şekil 3’te gösterildiği gibi aerobik solunumun genel sürecinde merkezi bir oyuncu haline getirir.
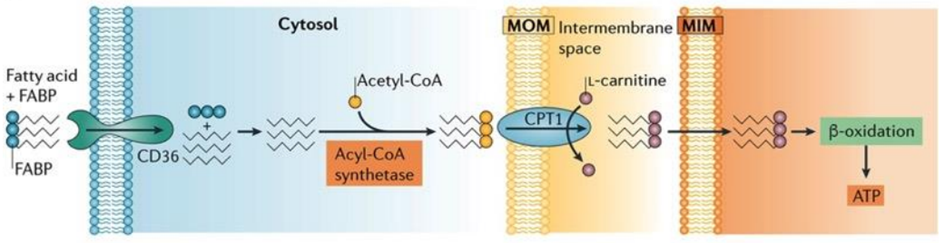
Yağ Asitleri: Verimli Yakıtlar Olarak Böbreğe Güç Verir
Proksimal tübül hücreleri ATP üretimi için en verimli mekanizma olan aerobik solunuma güvenir, çünkü iyon taşıma süreçlerine güç sağlama gerekliliği nedeniyle enerji talepleri büyüktür. Özellikle, yağ asitleri proksimal tübüller için önemli bir enerji kaynağı olarak ortaya çıkmaktadır, çünkü tek bir palmitat molekülü bir glikoz molekülüne kıyasla daha yüksek ATP çıktısı sağlamaktadır.
Proksimal tübül hücreleri yağ asitleriyle ilgili iki temel işlevden birini yerine getirebilir: ya sitoplazmalarında yağ asitlerini sentezler, karnitin mekiği yoluyla mitokondriye aktarmadan önce koenzim A ile aktive ederler ya da CD36 olarak da bilinen trombosit glikoprotein 4 gibi özelleşmiş taşıma proteinlerini kullanarak yağ asitlerini alabilirler.
Böbreğin proksimal tübül hücrelerinde yağ asitlerinin ATP’ye dönüşümü karmaşık ve hayati bir süreçtir. Yağ asitlerinin alınmasından veya sentezlenmesinden sonra, bu moleküllerin enerji elde etmek için metabolize edilmesi gerekir. Yağ asitleri ilk olarak karnitin mekiği aracılığıyla mitokondriye taşınır ve burada bir dizi enzimatik reaksiyona girer. Bu reaksiyonlar, yağ asitlerinin karbon zincirlerini aşamalı olarak kısaltan bir süreç olan beta-oksidasyon yoluyla yağ asitlerini parçalar. Sonuç olarak, yağ asitlerinin parçalanmasından asetil-CoA molekülleri üretilir. Asetil-CoA daha sonra mitokondride merkezi bir metabolik yol olan sitrik asit döngüsüne (Krebs döngüsü olarak da bilinir) girer. Sitrik asit döngüsünde, asetil-CoA yüksek enerjili elektronlar ve diğer ara ürünler üretmek için daha fazla işlenir. Bu yüksek enerjili elektronlar ETC’ye aktarılır ve burada sonuçta ATP üretimine yol açan bir dizi redoks reaksiyonunu yönlendirirler. Bu ATP daha sonra böbrek hücreleri tarafından besinlerin geri emilimi ve vücuttaki sıvı ve elektrolit dengesinin düzenlenmesi de dahil olmak üzere çeşitli temel işlevleri yerine getirmek için kullanılabilir.
Böbrek Hücreleri için Yakıt Olarak Amino Asitlerin Rolü
Amino asit taşıyıcıları proksimal tübülün luminal membranında bol miktarda bulunur ve bu nefron segmenti içindeki geri emilimleri, geri emilen bu amino asitlerin bazıları glukoneojenik substratlar olarak işlev görebileceğinden son derece önemlidir.
Böbrek sisteminin karmaşık yapısında, glomerulus serbest amino asitlerin geçmesine izin veren seçici bir filtre rolünü üstlenirken, proksimal tübül öncelikle bu amino asitlerin geri emilmesi sorumluluğunu üstlenir. Geri emilim sürecinin kendisi difüzyon, kolaylaştırılmış difüzyon ve sodyuma bağlı aktif taşıma gibi mekanizmaları içeren çok yönlü bir etkileşimdir. Ayrıca, bazolateral amino asit taşıyıcıları, her biri renal amino asit kullanımının genel verimliliğine katkıda bulunan spesifik fizyolojik işlevlere hizmet ederek geri emilim sürecini düzenlemede etkilidir.
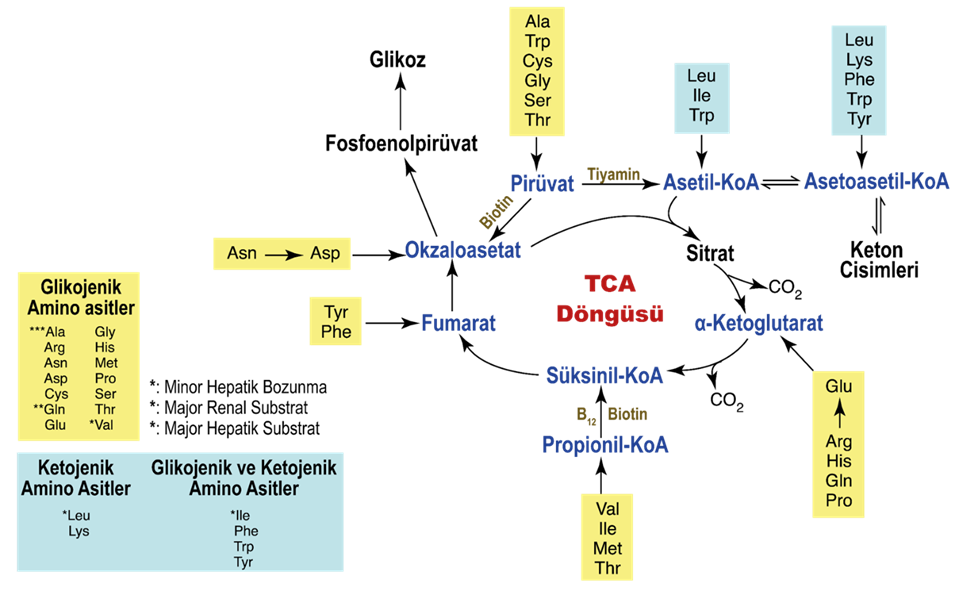
Alternatif olarak, amino asitler de oksidatif bir yolculuğa çıkabilir ve daha sonra farklı kavşaklarda trikarboksilik asit (TCA) döngüsüne girebilir. Kayda değer bir enerji kaynağı, lösin, valin ve izolösin içeren dallı zincirli amino asitlerde (BCAA) bulunur.
Dal zincirli α-ketoasit dehidrojenaz (BCKDH) kompleksi, BCAA’ların metabolik yolunda çok önemli bir rol oynar ve dal zincirli aminotransferazlar (BCAT) tarafından BCAA’nın ilk transaminasyonunu takiben oksidatif bir dekarboksilasyon reaksiyonu başlatarak dal zincirli α-ketoasitler verir. BCAA’ların katabolizmasından kaynaklanan metabolitler, TCA döngüsünün oksidatif yollarından geçerek süksinil-CoA veya asetil-CoA oluşumuna yol açar. Özellikle böbrek, kalp ve kahverengi yağ dışında, hem BCAT hem de BCKDH’nin ekspresyonu ve aktivitesinin belirgin bir şekilde gözlendiği tek doku olarak durmakta ve böbreğin BCAA’ların güçlü oksidatif akışındaki ayırt edici rolünün altını çizmektedir.
Böbrek Hücrelerinde Enerji Metabolizmasının Hormonal Düzenlenmesi
İnsülin: Pankreas tarafından sentezlenen endokrin bir hormon olan insülin, glikoz metabolizmasının titizlikle kontrol edilmesinde çok önemli bir role sahiptir. Etkisi böbreklere kadar uzanır ve burada glikoz alımını ve kullanımını uyarır, böylece optimal kan glikoz seviyelerinin korunmasına yardımcı olur.
Kortizol: Böbreküstü bezleri tarafından üretilen bir steroid hormonu olan kortizol, metabolik süreçlerin ve enerji dengesinin karmaşık bir şekilde düzenlenmesinde etkilidir. Böbrek çerçevesinde kortizol, yeni glikozun üretildiği bir süreç olan glukoneogenezi teşvik eder ve proteinlerin ve yağların katabolizmasını artırarak bu molekülleri enerji üretimine yönlendirir.
Epinefrin ve Norepinefrin: Her ikisi de böbreküstü bezlerinden kaynaklanan ve “savaş ya da kaç” tepkisiyle yakından ilişkili olan epinefrin ve norepinefrin böbrek fonksiyonlarını etkiler. Bu hormonlar böbrekler tarafından glikoz salınımını uyarır ve stres veya zorlu durumlar sırasında ortaya çıkan acil enerji gereksinimlerini karşılamak için vücudun depolanmış glikoz rezervleri olan glikojenin yıkımını artırır.
Bu makale öğrencimiz Deniz Usta’nın sunumundan hazırlanmıştır.
Referanslar
Bhargava P, Schnellmann RG (2017). Mitochondrial energetics in the kidney. Nat Rev Nephrol., 13(10):629-646. doi: 10.1038/nrneph.2017.107.
Gewin LS (2021). Sugar or Fat? Renal Tubular Metabolism Reviewed in Health and Disease. Nutrients., 13(5):1580. doi: 10.3390/nu13051580.
National Institute of Diabetes and Digestive and Kidney Disease (NIDDK) (2023). Your Kidneys & How They Work.
Reece WO, Rowe EW (2017). Functional Anatomy and Physiology of Domestic Animals. 5th edition. Wiley-Blackwell
Sahay M, Kalra S, Bandgar T (2012). Renal endocrinology: The new frontier. Indian J Endocrinol Metab., 16(2):154-5. doi: 10.4103/2230-8210.93729.
Singh S, Sharma R, Kumari M, Tiwari S (2019). Insulin receptors in the kidneys in health and disease. World J Nephrol., 8(1):11-22. doi: 10.5527/wjn.v8.i1.11.

