Yazar: Doğa İsmailoğlu
Miyokardiyal metabolizma, sürekli ve güçlü kasılması için gereken enerjiyi sağlamak üzere kalp kası veya miyokardiyum içinde meydana gelen karmaşık biyokimyasal süreçleri ifade eder.
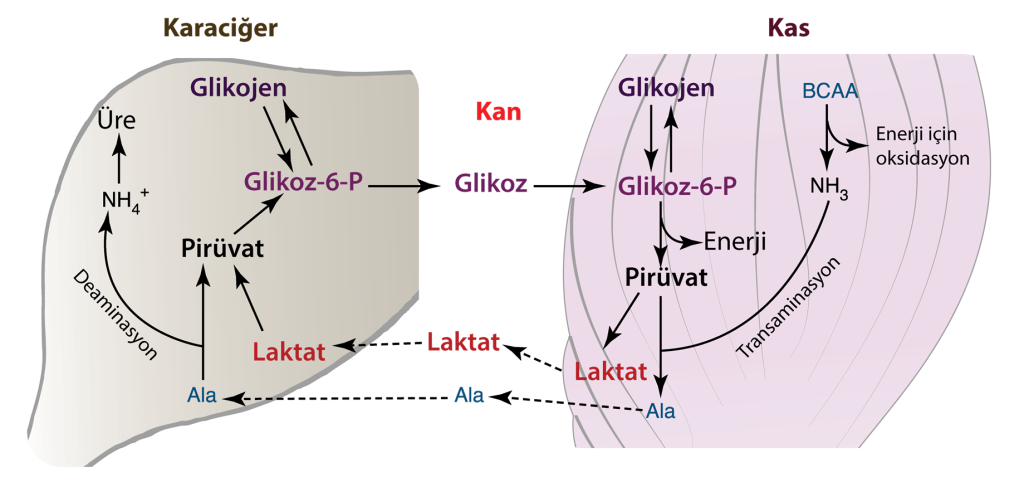
Kalp, tüm organlarımız arasında en yüksek metabolik ihtiyaca sahiptir. Bu nedenle, miyokardiyal metabolizma biyokimyacılar için ilgi çekici bir alandır. Kalp, kas kasılmasını, sarkomer gevşemesini ve Na+/K+-ATPaz gibi süreçlerde görüldüğü gibi iyonların hücre zarı boyunca aktif taşınmasını kolaylaştırmak için yeterli ATP kaynağına ihtiyaç duyar. Bu enerji talebi oksijen mevcudiyetine bağlıdır. Yeterli oksijen kaynağı mevcut olduğunda, glikoliz aerobik olarak gerçekleşir ve trikarboksilik asit (TCA) döngüsüne ve elektron taşınmasına ilerler. Oksijenin sınırlı olduğu veya bulunmadığı durumlarda, anaerobik glikoliz gerçekleşir, piruvat aşamasında durur ve daha sonra laktata dönüştürülür. Bu laktat daha sonra karaciğere taşınır ve burada glukoneogenez yoluyla glukoza dönüştürülür. Kalp kasında Cori döngüsü, egzersiz sırasında veya belirli hastalık durumlarında olduğu gibi yüksek enerji talebi veya stres durumlarında aktif hale gelebilir.
Cori Döngüsü mikokardiyal metabolizma için hayatidir
Cori döngüsü, özellikle enerji talebi arttığında veya oksijen mevcudiyeti sınırlandığında, kalp kası ve diğer dokularda enerji üretimi ve glikoz dengesinin korunmasında hayati bir rol oynar. Kalp kasında Cori döngüsü aşağıdaki aşamalardan oluşur.
Glikoliz: Glikoz, kalp kası hücrelerinin sitoplazması içinde bir dizi kimyasal reaksiyondan oluşan glikolize uğrar. Bu süreç piruvat ve az miktarda ATP üretir.Glikoliz: Glikoz, kalp kası hücrelerinin sitoplazması içinde bir dizi kimyasal reaksiyondan oluşan glikolize uğrar. Bu süreç piruvat ve az miktarda ATP üretir.
Laktat üretimi: Oksijenin az olduğu veya enerji ihtiyacının yüksek olduğu dönemler gibi belirli senaryolarda piruvat anaerobik glikoliz yoluyla laktata dönüştürülür. Daha sonra laktat kan dolaşımına salınır.
Laktat Alımı: Kalp kası içinde üretilen laktat, karaciğer, iskelet kasları ve hatta diğer kalp kası hücreleri dahil olmak üzere çeşitli dokular tarafından emilme kapasitesine sahiptir. Bu dokularda enerji kaynağı olarak kullanılabilir veya glikoza dönüştürülebilir.
Glikoz Rejenerasyonu: Karaciğer gibi laktat alan dokularda, laktatı tekrar glikoza dönüştürebilen glukoneogenez adı verilen bir süreç vardır. Bu glikoz daha sonra kan dolaşımına salınır ve kalp kası hücreleri tarafından alınır, burada bir enerji kaynağı olarak kullanılır ve Cori döngüsünü etkili bir şekilde tamamlar.
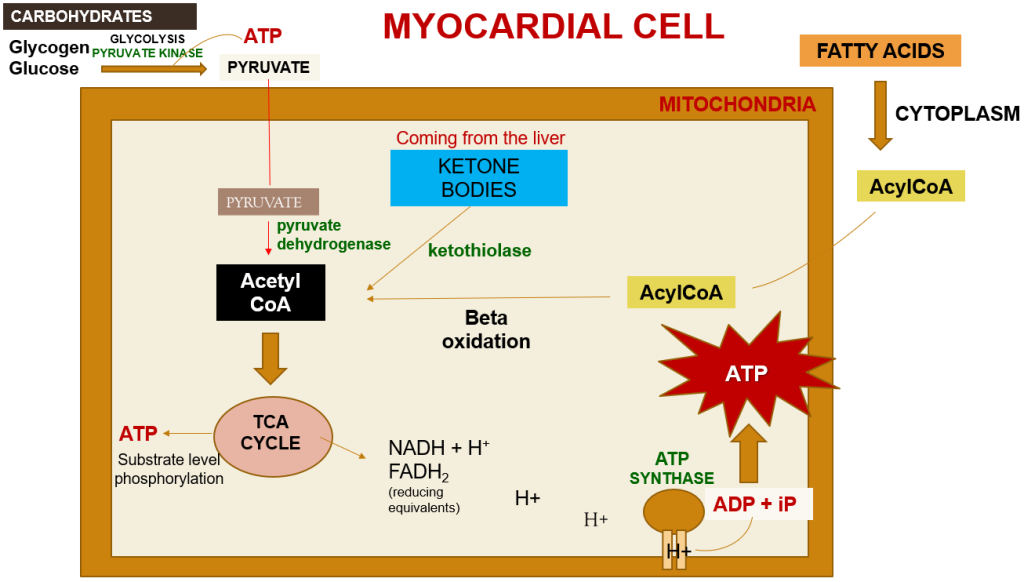
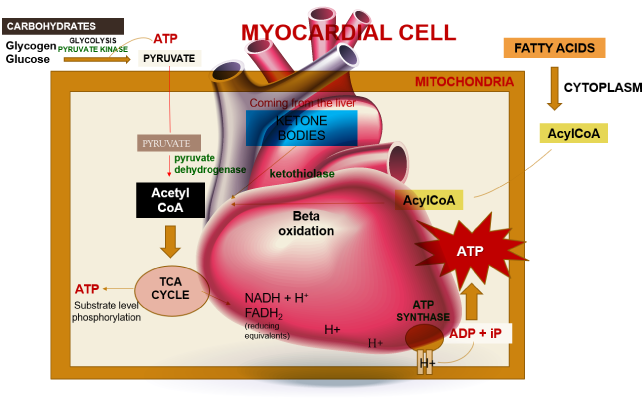
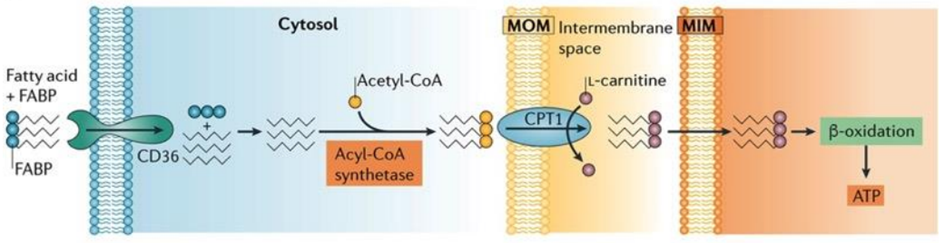
Kalbin enerji gereksinimleri oksijenin ötesinde substratların mevcudiyetinden de etkilenir. Kardiyak ATP’nin yaklaşık %70’i, yetişkin bir kalp için birincil enerji kaynağı olarak hizmet eden yağ asitlerinin beta-oksidasyonu yoluyla üretilir. Bu yağ asitleri şilomikronlardan kaynaklanır ve trigliseritlerin lipoprotein lipaz tarafından hidrolizi sonucu oluşur. Öte yandan karbonhidratlar fetal kalp için ve iskemi gibi stresli koşullar altında yetişkin kalbi için enerji kaynağı olarak hizmet eder.
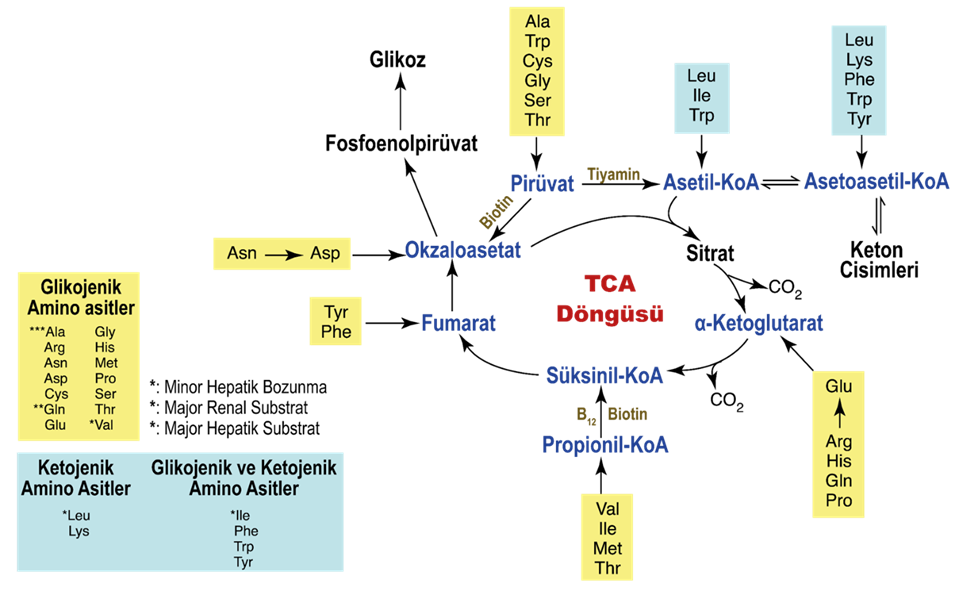
Açlık gibi olağandışı durumlarda, amino asitler ve keton cisimleri de metabolizmada ATP üretmek için kullanılabilir. Substratların yanı sıra, ATP sentezini desteklemek için A, D, E ve K gibi yağda çözünen vitaminleri içeren ek bir besin gereksinimi vardır. Bu vitaminler şilomikronlarda ve dolaşımdaki lipoproteinlerde bulunur ve lipoprotein lipazın etkisiyle salınır. D vitamini bağırsaklardan kalsiyum emiliminde önemli bir rol oynar. TPP (tiamin), NAD (niasin) ve FAD (riboflavin) gibi koenzimlerin yanı sıra kalsiyum, sodyum, potasyum ve klorür gibi elektrolitler de ATP üretimi için gereklidir.

Bir miyokard hücresi içinde, miyokardiyal metabolizma, kan dolaşımından gelen glikoz ve miyokardda depolanan glikojen, piruvat kinaz enziminin yardımıyla glikolizden geçerek piruvat üretimine yol açar. Bu işlem sırasında substrat düzeyinde fosforilasyon gerçekleşir ve az miktarda ATP elde edilir. Bu piruvat daha sonra mitokondriye taşınır ve burada piruvat dehidrojenaz enzim kompleksi tarafından asetil-CoA’ya dönüştürülür. Ayrıca, asetil-CoA karaciğer tarafından sentezlenen ancak kullanılmayan keton cisimlerinden de üretilebilir ve ketotiyolaz enzimi bu süreçte rol oynar.

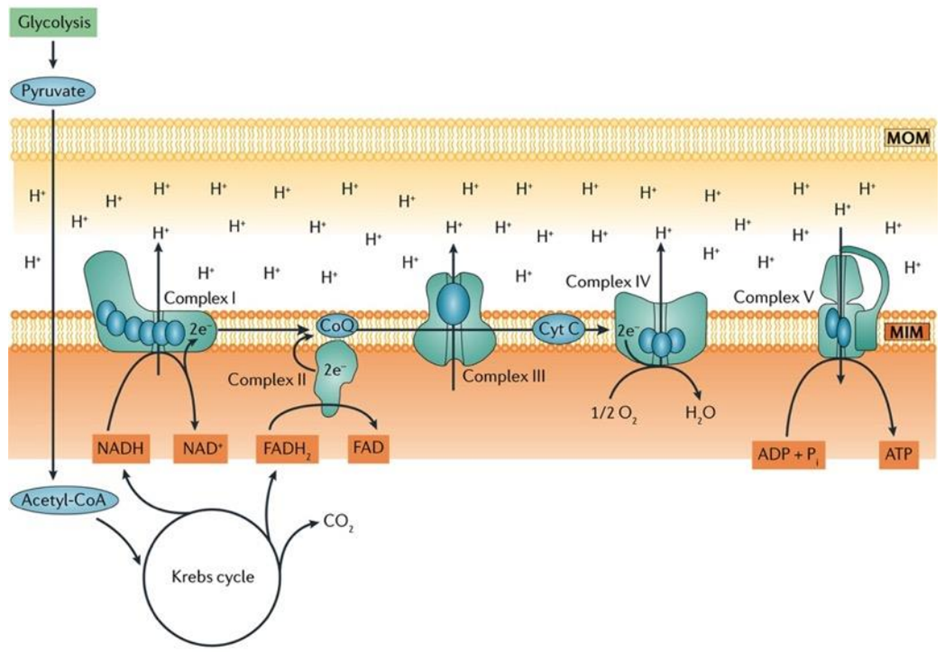
Yağ asitleri sitoplazmada Asil-CoA’ya aktive edilir ve daha sonra mitokondriye taşınır, burada beta-oksidasyon yoluyla asetil-CoA’ya dönüştürülür. Bu asetil-CoA, oksaloasetat ile birleşerek TCA döngüsüne girer. TCA döngüsü içinde, substrat düzeyinde fosforilasyon bir kez daha gerçekleşir ve az miktarda ATP üretilir. ATP üretiminin yanı sıra, TCA döngüsü ayrıca elektron taşıyıcısı olarak görev yapan NADH+H+ ve FADH2 üretir. Bu elektronlar bir kompleksten diğerine geçerken protonlar intramembranöz boşluğa girer. Bu protonlar daha sonra ATP sentazdan geçerek yüksek hızda dönmesine neden olur ve bu da ATP oluşturmak için ADP ve Pi kombinasyonunu kolaylaştırır.
Bu yeni oluşan ATP, karaciğer tarafından üç amino asitten (glisin, arginin ve metiyonin) sentezlenen bir bileşik olan kreatin ile birleşir. Bu kombinasyon, miyokardiyal hücrelerin sitoplazmasında kreatin ve ATP’den sentezlenen kreatin fosfat oluşumuyla sonuçlanır. Daha da önemlisi, miyokardiyal kasılma sırasında olduğu gibi yüksek enerji ihtiyacı dönemlerinde hızla tekrar ATP’ye dönüştürülebilir. Miyokardiyumda bulunan kreatin kinaz enzimi, yüksek enerjili bir fosfat grubunun kreatin fosfattan ADP’ye transferini katalize ederek ATP’yi etkin bir şekilde yeniden üretir. Bu süreç, kalp hızının arttığı veya stresin yükseldiği zamanlarda miyokardiyal kasılma fonksiyonunu desteklemek için hızlı bir ATP kaynağı sunar.
Çeşitli hayvan türlerinin kalp hastalıklarına duyarlı olduğu bilinmektedir.
Köpekler: Boxer, Doberman Pinscher, Danua ve Cavalier King Charles Spaniel gibi bazı köpek ırkları, dilate kardiyomiyopati (DCM) ve mitral kapak hastalığı gibi belirli kalp rahatsızlıklarına yatkındır. DCM, kalbin zayıflaması ve büyümesi ile karakterize olup, kan pompalamada daha az verimli hale gelir ve yorgunluk, solunum güçlüğü ve sıvı tutulumu gibi semptomlara neden olur. Mitral kapak hastalığı, sol atriyum ve sol ventrikül arasındaki kapakçığın hatalı kapanmasını içerir ve kan sızıntısına yol açarak kalp odacıklarının genişlemesine ve öksürük, solunum sorunları ve kalp üfürümleri gibi semptomlara neden olabilir.
Kediler: Hipertrofik kardiyomiyopati (HCM), özellikle Maine Coon, Ragdoll ve Sphynx gibi ırkları etkileyen yaygın bir kedi kalp rahatsızlığıdır. HCM, kalp duvarlarının kalınlaşmasını içerir, pompalama verimliliğini azaltır ve uyuşukluk, solunum güçlüğü ve düzensiz kalp atışları gibi semptomlara neden olur.
Atlar: Atlar da atriyal fibrilasyon, kalp kapak hastalığı ve miyokardit gibi kalp hastalıklarından muzdarip olabilir. Atriyal fibrilasyon, kulakçıkları etkileyen anormal bir kalp ritmi anlamına gelir.
Kuşlar: Başta papağanlar ve güvercinler olmak üzere bazı kuş türleri kalp yetmezliği ve damar sertliği gibi kardiyovasküler hastalıklara karşı savunmasız olabilir.
Bu makale öğrencimiz Doğa İsmailoğlu’nun sunumundan hazırlanmıştır.
Referanslar
Heinrich Taegtmeyer (2012). Chapter 15 – Cardiomyocyte Metabolism: All Is in Flux, Editor(s): Joseph A. Hill, Eric N. Olson, Muscle, Academic Press, Pages 187-202, ISBN 9780123815101 https://doi.org/10.1016/B978-0-12-381510-1.00015-6.
Kodde IF, van der Stok J, Smolenski RT, de Jong JW (2007). Metabolic and genetic regulation of cardiac energy substrate preference. Comp Biochem Physiol A Mol Integr Physiol., 146(1):26-39. https://doi.org/10.1016/j.cbpa.2006.09.014
Kalp hastalıklarına Yatkın Irklar (2023). Veteriner Kardiyoloji. Available at:
http://kardiyoloji.veterinary.ankara.edu.tr/hangi-irk-hangi-kalp-hastaligina-yatkindir/
(Accessed: 27 October 2023).


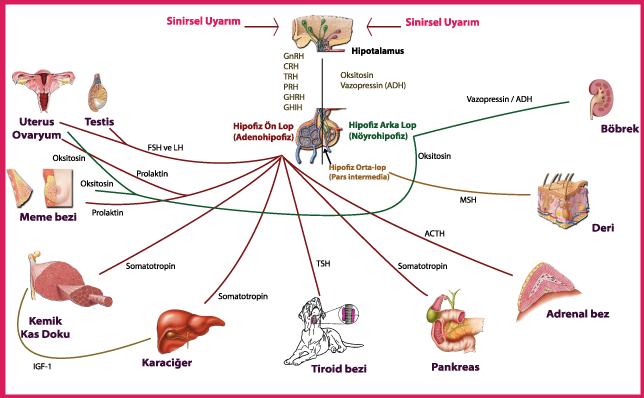



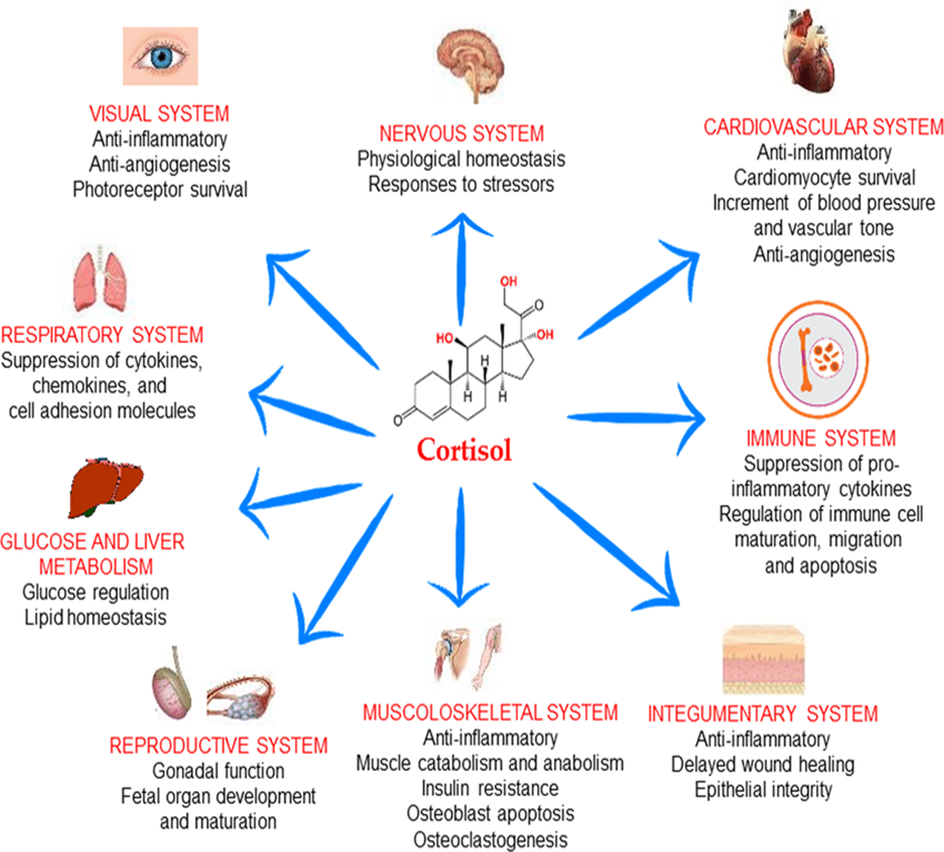
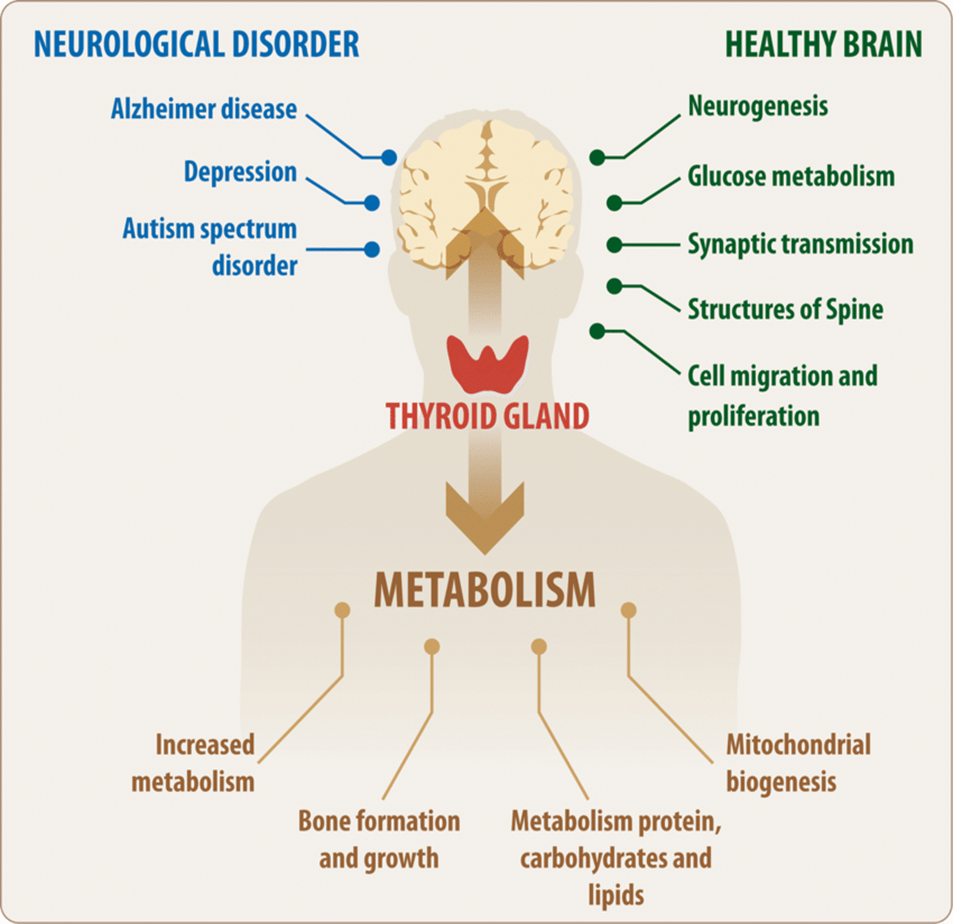
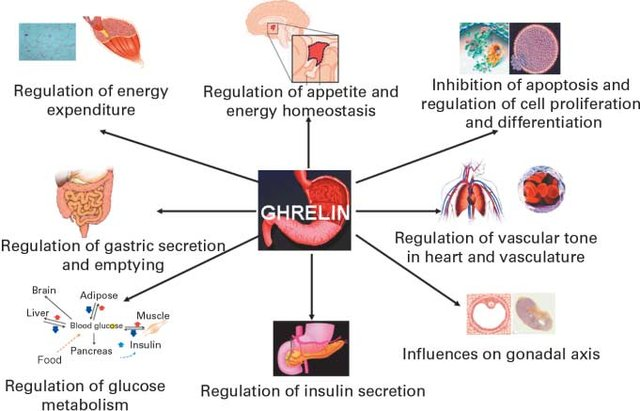

 Sir Hans Adolf Krebs 20. yüzyılın başında, 25 Ağustos 1900’de Almanya’nın Hildesheim şehrinde doğdu. Kulak, burun ve boğaz cerrahı Dr. Georg Krebs ve eşi Alma Davidson’ın oğlu olarak dünyaya geldi. Hans Krebs 1918-1923 yılları arasında Göttingen Üniversitesi, Freiburg-im-Breisgau ve Berlin Üniversitelerinde tıp eğitimi aldı. 1925’te Münih Üniversitesi’nden mezun oldu ve hekim ünvanını (MD) aldı.
Sir Hans Adolf Krebs 20. yüzyılın başında, 25 Ağustos 1900’de Almanya’nın Hildesheim şehrinde doğdu. Kulak, burun ve boğaz cerrahı Dr. Georg Krebs ve eşi Alma Davidson’ın oğlu olarak dünyaya geldi. Hans Krebs 1918-1923 yılları arasında Göttingen Üniversitesi, Freiburg-im-Breisgau ve Berlin Üniversitelerinde tıp eğitimi aldı. 1925’te Münih Üniversitesi’nden mezun oldu ve hekim ünvanını (MD) aldı.