Hücrenin önemli bir organeli olan lizozomlar 1955 yılında Belçikalı biyokimyacı Christen de Duve tarafından keşfedilmiştir. Sürekli dondurulup çözdürülen hücrelerin salgıladığı bir enzimin farklı organelden geldiğini ortaya çıkarmış ve bu organele Lizozom adını vermiştir. Bu organellerin, bakteri ve yıpranmış hücrelerin parçaları gibi farklı tipteki materyallerin ayrıştırılmasında önemli işlevleri olduğunu keşfetmiştir. Bu keşfi nedeniyle 1974 Nobel Tıp ödülüne layık görülmüştür 1.
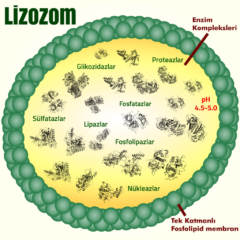
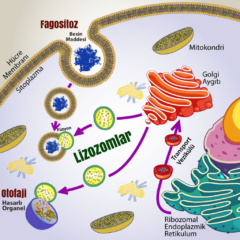
Lizozomlar, hücreler ölmek üzereyken hücreleri çözme işlevine hizmet eden organellerdir (otofaji). Lizozomlar hücrenin atıklarını ortadan kaldıran sistemi olarak bilinir ve hem hücrenin dışından hem de hücre içindeki eski bileşenlerden sitoplazmada istenmeyen maddeleri sindirerek hareket ederler. Hemen hemen tüm ökaryotik hücrelerde bulunan fosfolipid yapısında tek katmanlı membranı bulunan sitoplazmik organellerdir. Golgi cisimciğinde üretilirler. Büyüklükleri ve şekilleri bulundukları hücreye bağlı olarak değişkenlik gösterir. Ancak şekilleri genel olarak dairesel yapıdadır. Tek katmanlı membranın yapısında, lümen ile organel arasındaki transport sistemleri, elektrojenik proton pompası ve membran proteinleri yer almaktadır 2. Bunlar, endozomal/lizozomal sistemin başlıca degradatif kompartımanı ve proteinler, glikokonjugatlar, lipidler ve nükleik asitler gibi çeşitli makromoleküllerin yapı bloklarına ayrıldığı endositik yolakların terminal kısmıdır. Hücreler içerisinde makromoleküllerin yıkımı ve geri dönüşümünü etkileyen membran dinamikleri, homeostazın korunmasında kritik bir rol oynar. Degredasyona uğramış makromoleküller endozomal/lizozomal sisteme bu yolakların terminal kısmından girebilir 3.
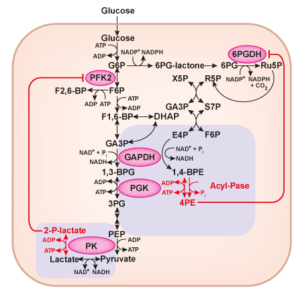
Lizozomların 60’tan fazla farklı enzim içerdikleri bilinmektedir. Sitoplazmanın pH’sı 7.4 iken lizozomlar içerisindeki optimal pH 4.5-5’tir. İçeriğindeki enzimler asit hidolaz sınıfıdır ve asidik ortamda aktifken bazik ve nötral ortamlarda aktivite göstermezler. Bu özellikleri sayesinde hücreye genel olarak bir koruma sağlarlar. Lizozomal enzimlerin kontrolsüz bir şekilde sitoplazmaya sızarak hücrenin sindirilmesi önlenmiş olunur. Lizozomal enzimlere nükleazlar, proteazlar, glikozidazlar örnek olarak verilebilir. Lizozomlar içindeki asidik ortamın korunmasında, lizozomal membranda bulunan hidrojen (proton) pompası rol oynar. Proton pompası, aktif transport ile sitozolden lümene hidrojen iyonlarını pompalayarak asidik ortamı sabit halde tutar. Lizozomal membranlarda çok sayıda glikoprotein bulunmaktadır. Özellikle membranın lümene bakan yüzündeki proteinler yüksek oranda glikozillenmiştir. Glikoproteinler glikokaliks yapısı oluşturarak lizozomu asit hidrolazların etkisinden korur 4.
Lizozomların Başlıca Görevleri
Lizozomal enzimler protein, DNA, RNA, polisakkaritler ve lipidleri hidrolize ederler. Bunun yanında hücre içine giren bakteri, virüs otomatik parçalama işlemiyle sindirmekten sorumludurlar. Hücre hasar gördüğünde, lizozomlar patlayabilir ve enzimler kendi hücrelerini sindirebilirler. Bu nedenle, lizozomlar hücrenin intihar torbaları olarak da bilinir. Ancak bu özellik, bir hücre hasar gördüğünde veya hücrenin bölümleri artık fonksiyonelliğini kaybettiği zaman devreye girer. Yani, yaşlı hücreleri ve gerekli olmayan yapıları, moleküllerin tekrar kullanılabilmesi amacıyla parçalar. Apoptoz; programlanmış hücre ölümüdür. Bu sistem sayesinde vücut için gerekli olmayan hücreler ya da görevini tamamlayanlar hücre içinde programlanarak sindirilir. Lizozomların ve lizozomal proteazların, apoptoz sırasında hücreler için intihar eden hücre ölüm yollarına katıldığı bilinmektedir. Polimerleri parçalayabilmenin yanı sıra, lizozomlar diğer organelleri kaynaştırır ve hormon, protein, karbonhidrat, lipid gibi büyük yapıları veya hücresel birikintileri sindirebilir. Lizozomlar, içinde yer alan proteinleri diğer proteinlerden ayıran ve onların lizozoma yönlenmesini sağlayan özellik, sentezden sonra golgi cisimciğinde uğradıkları modifikasyon ile kazandıkları mannoz-6-fosfat (M6P) rezidüleridir. Trans-golgide yer alan M6P reseptörleri yeni sentezlenen lizozomal enzimlerin lizozomlar içinde toplanmasını sağlar 5.
Lizozomların genel olarak dört farklı etki şekli vardır. Bunlar:
1.Ekzositoz: Lökosit ve makrofajlar, doku harabiyeti olan yere hücum ederler. Burada hücre içine alınan partikülleri lizozomlar sindirir.
2.Otofaji: Bu olayda, hücrenin zarar gören ve işlevini yapamaz hale gelen komponentleri lizozom içine alınmakta ve sindirilmektedir.
3.Otoliz: Lizozom membranının açılarak hücrenin kendini parçalamasıdır. Canlı hücreler zarar gören yapılarını mümkün olduğu kadar onarmaya çalışırlar. Bu onarım durduğu anda ilk zarar görecek yer lizozom membranıdır. Ölümden kısa bir süre sonra kokuşmanın başlama nedeni, lizozom membranlarının parçalanması ve enzimlerinin serbest kalmasıdır.
4.Pinositoz: Tiroid bezi hücreleri lümendeki kolloid maddeyi (tiroglobulin) pinositoz yoluyla alırlar. Pinositotik vezikül lizozom ile birleşerek lizozomun hidrolazları tiroglobulini parçalar ve tiroid hormonu sentezlenerek salınır 6.
Lizozomlar ve Hastalıkla İlişkisi
Lizozomal enzim defektleri ile ilgili hastalıklarda, hücre içinde yıkılmış komponentler çözünmemiş ürünler olarak birikerek fonksiyon bozukluğuna yol açarlar. Bu durumun yol açtığı klinik durumlara Lizozomal Depo Hastalıkları denir. 30’dan fazla hastalık tanımlanmıştır. Mutasyona uğramış genler nedeniyle bu hastalıklar ortaya çıkmaktadır. Lizozomal depo hastalıkları hayvan ve insanlarda farklılıklar gösterir ve farklı açılardan büyük öneme sahiptirler.
Hayvanların Lizozomal Depo Hastalıklarına örnek verilecek olursa; Alfa–mannosidoz evcil hayvanlarda görülen en yaygın ve ekonomik yönden de öneme sahip olan bir Lizozomal Depo Hastalığıdır. Otozomal resesif kalıtımla geçtiği bilinmektedir 7.
GM1 gangliosidoz, lizozomal beta–galaktosidaz enziminin eksikliği sonucu şekillenen, GM1 gangliosidlerin intralizozomal birikimi ile karakterize ölümcül nörodejeneratif ve nörovisseral bir hastalıktır. Hastalığın otozomal resesif kalıtımla geçtiğine dair çalışmalar bulunmaktadır. İlk kez 1971 yılında Siyam kedisinde tanımlanmış ve bunun çocuklarda meydana gelen GM1 gangliosidoz ile aynı özellik taşıdığı bildirilmiştir. GM1 gangliosidoz kedi, köpek ve koyun gibi hayvanlarda görülmektedir 8.
Sonuç olarak , hücrenin intihar torbaları olarak bilinen lizozomlar diğer organeller ile bir uyum içinde çalışmakta ve canlı organizmanın bütünlüğünün korunmasında önemli görevleri yürütmektedir.
Kaynaklar
- “Christian de Duve-Facts”. Nobelprize.org. Nobel Media AB 2014. Web. 10 Aug 2018. http://www.nobelprize.org/nobel_prizes/medicine/laureates/1974/duve-facts.html.
- Lodish H, Berk A, Kaiser CA, et al. Molecular Cell Biology. 5th ed. (Lodish H, Berk A, Kaiser CA, et al., eds.). New York, US: W. H. Freeman, Macmillian Learning; 2016.
- Hu YB, Dammer EB, Ren RJ, Wang G. The endosomal-lysosomal system: From acidification and cargo sorting to neurodegeneration. Transl Neurodegener. 2015;4(1):1-10. doi: https://doi.org/10.1186/s40035-015-0041-1
- Aksoy ZB, Soydemir E. Lizozomal Aktivite. Güncel Gastroenteroloji. 2016;20(4):345-352.
- Dinçel GÇ, Kul O. Evcil Hayvanların Lizozomal Depo Hastalıklarında Patogenez ve Patolojik Bulgular. Gümüşhane Univ J Heal Sci. 2015;4(4):614-637.
- Schwake M, Schröder B, Saftig P. Lysosomal Membrane Proteins and Their Central Role in Physiology. Traffic. 2013;14(7):739-748. doi: https://doi.org/10.1111/tra.12056
- Jolly RD, Walkley SU. Lysosomal storage diseases of animals: an essay in comparative pathology. Vet Pathol. 1997;34(6):527-548. doi: https://doi.org/10.1177/030098589703400601
- Warren CD, Alroy J. Morphological, biochemical and molecular biology approaches for the diagnosis of lysosomal storage diseases. J Vet Diagnostic Investig. 2000;12(6):483-496. doi: https://doi.org/10.1177/104063870001200601



 Sir Hans Adolf Krebs 20. yüzyılın başında, 25 Ağustos 1900’de Almanya’nın Hildesheim şehrinde doğdu. Kulak, burun ve boğaz cerrahı Dr. Georg Krebs ve eşi Alma Davidson’ın oğlu olarak dünyaya geldi. Hans Krebs 1918-1923 yılları arasında Göttingen Üniversitesi, Freiburg-im-Breisgau ve Berlin Üniversitelerinde tıp eğitimi aldı. 1925’te Münih Üniversitesi’nden mezun oldu ve hekim ünvanını (MD) aldı.
Sir Hans Adolf Krebs 20. yüzyılın başında, 25 Ağustos 1900’de Almanya’nın Hildesheim şehrinde doğdu. Kulak, burun ve boğaz cerrahı Dr. Georg Krebs ve eşi Alma Davidson’ın oğlu olarak dünyaya geldi. Hans Krebs 1918-1923 yılları arasında Göttingen Üniversitesi, Freiburg-im-Breisgau ve Berlin Üniversitelerinde tıp eğitimi aldı. 1925’te Münih Üniversitesi’nden mezun oldu ve hekim ünvanını (MD) aldı.