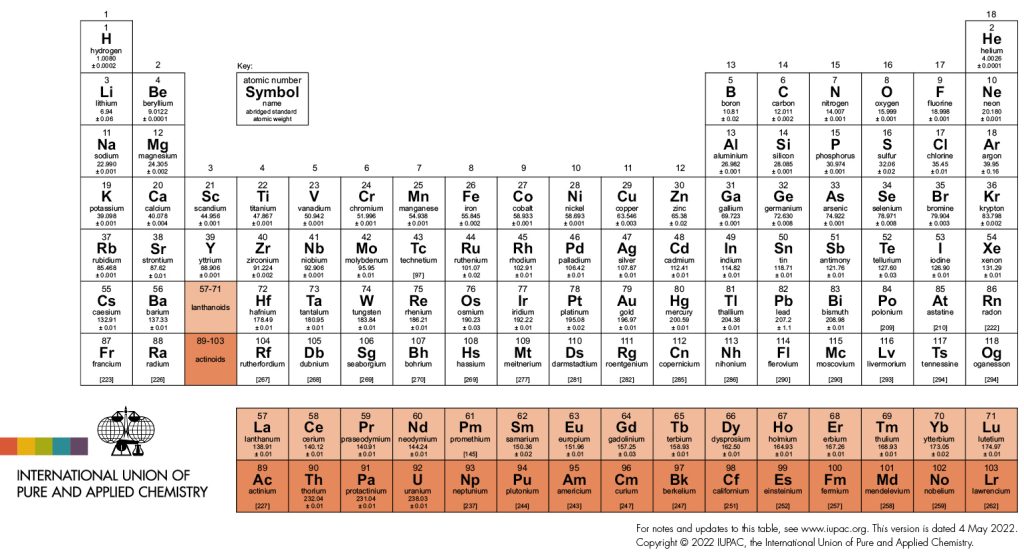
Periyodik Tablo elementlerin sınıflandırılması için geliştirilmiş bir tablodur. Periyodik tabloda elementlerin atom numaralarına bağlı olarak yerleri değiştikçe atom çapları ve elektron dizilişleri farklılık gösterir.
En son güncellenen haliyle Periyodik Tablo’ da toplam 118 element bulunur. Bunların 94 adeti doğal elementlerdir. 24 adeti ise sentetik elementlerdir. 80 elementin en az 1 tane stabil izotopu vardır. 38 adetinin radyoaktif izotopları vardır ve zamanla bozunuma uğrarlar. Kütlece dünyada en çok Fe bulunur. Oksijen ise yer kabuğunda en yaygın bulunan elementtir.
Rakamlarla Periyodik Tablo
- En son güncellenen haliyle Periyodik Tablo’da toplam 118 element bulunur. Bunların 94 adeti doğal elementlerdir. 24 adeti ise sentetik elementlerdir.
- 80 elementin en az 1 tane stabil izotopu vardır.
- 38 adetinin radyoaktif izotopları vardır ve zamanla bozunuma uğrarlar.
- Kütlece dünyada en çok Fe bulunur.
- Oksijen ise yer kabuğunda en yaygın bulunan elementtir.
Bilgi Notu
(8 Şubat 1834 – 2 Şubat 1907)
Rus kimyager Dmitri Mendeleev periyodik kanunu keşfetti ve elementlerin periyodik tablosunu yarattı. En çok Periyodik Kanun’u formüle etmesi ve periyodik element tablosunun ileri görüşlü bir versiyonunu yaratmasıyla tanınır. Periyodik kanunu yalnızca uranyumun değerliliği ve atom ağırlığı gibi bilinen bazı elementlerin o zamanlar kabul edilen özelliklerini düzeltmek için değil, aynı zamanda henüz keşfedilmemiş üç elementin özelliklerini de tahmin etmek için kullandı.
(19 Ağustos 1830 – 11 Nisan 1895)
Alman kimyagerdi. Kimyasal elementlerin periyodik tablosunun en eski versiyonlarını geliştirmede öncülerden biriydi. Rus kimyager Dmitri Mendeleev’in baş rakibiydi ve ikisi de Robert Bunsen ile çalışmıştır. Meyer asla ilk adını kullanmadı ve hayatı boyunca sadece Lothar Meyer olarak biliniyordu.


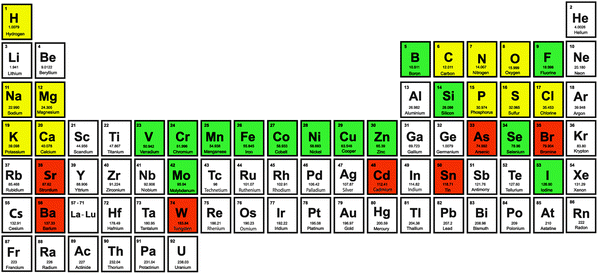
(Sarı: Bol bulunan biyolojik elementler/Makro elementler; Yeşil: Bakteri, bitki ve hayvanlar için esansiyel İz elementler; Kırmızı: Bazı türlerde muhtemel esansiyel iz elementler)
Elementlerin Bazı Niteliklerinin Periyodikliği: Periyodik Eğilimler
Atom ve İyon Yarıçapı: Çekirdek merkezi ile, değerlik (valans) elektronları denen, en dıştaki elektronlar arasındaki uzaklıktır. Atom ve iyon yarıçapı, bir grup içerisinde aşağıdan yukarıya, periyod içerisinde soldan sağa azalır.
Metalik Karakter: Bir elementin metalik karakteri, bir atomun bir elektronu ne kadar kolay kaybedebileceği olarak ifade edilir. Metalik karakter atom boyutu (atom yarıçapı) ile ilişkilidir ve atom boyutu artınca metalik karakterde artar. Metalik özellikler bir periyot boyunca soldan sağa ve grupta aşağıdan yukarı doğru azalır.
İyonizasyon Enerjisi: Bir atomdan bir elektronun ayrılmasına iyonizasyon denir. Bir iyonizasyon için gerekli olan enerji miktarına ise iyonizasyon enerjisi adı verilir. Bir başka ifade ile gaz halindeki nötr bir atomdan bir elektronu koparmak için gereken enerjidir. Elementlerin iyonizasyon enerjileri gruplarda aşağıdan yukarı, periyod içinde soldan sağa artar.
Elektronegativite: Bir atomun kovalent bir bağ içerisinde elektron çekme yeteneğidir. Elektronegatiflik, bir atomun elektronları çekme ve elektronlarla bağ oluşturma eğilimini ölçer. Bu özellik, atomların elektronik konfigürasyonu nedeniyle mevcuttur. Elektronegativite periyod boyunca soldan sağa, grup içinde aşağıdan yukarı doğru artar. Bu kuralın önemli istisnaları arasında soy gazlar, lantanitler ve aktinitler bulunur. Soy gazlar tam bir değerlik kabuğuna sahiptir ve genellikle elektronları çekmezler. Lantanitler ve aktinitler, genellikle herhangi bir eğilimi takip etmeyen daha karmaşık kimyaya sahiptir. Bu nedenle soy gazlar, lantanitler ve aktinitlerin elektronegatiflik değerleri yoktur.
Flor en elektronegatif elementtir.
Elektron ilgisi (afinitesi): Bir elementte var olan bir enerji sayesinde bir başka elementin elektronunun alınmasına denir. Bir başka ifade ile elektron ilgisi, bir atomun bir elektronu kabul etme yeteneğidir. Elektroaffinite halojenlerde en yüksektir.

Son Düzenleme: 12 Ağustos 2023

