Pek çok elementin atomları başka atomlara bağlanarak daha kompleks yeni moleküller oluştururlar. Birden fazla atomu veya iyonu bir arada tutan intra-moleküler (molekül içi) kuvvete kimyasal bağ adı verilir. İşte kimyasal bağlar aracılığı ile moleküller ortaya çıkar. Çekirdek yüküne, elektronların çekirdek etrafında dağılımına ve atomların yarıçapına bağlı olarak farklı kimyasal bağlar meydana gelir.
Atomların kombinasyonları ile oluşan bileşiklere molekül denir ve moleküller kimyasal bağlar aracılığı ile meydana gelir. Moleküller elektriksel açıdan yüksüzdürler ve belirli sayıda birçok atomu içerirler. Moleküller kendilerini oluşturan atomlardan başka bir üründür. Tamamıyla yeni niteliklere sahiptir ve atomlar arası bağlarla bir arada tutulmaktadır. Molekülü oluşturan tüm atomlar reaksiyona girer ve herhangi parçacık kaybı söz konusu değildir.
Biyokimyasal açıdan en önemli molekül şüphesiz ki yaşayan her canlının olmazsa olmazı olan sudur ( H2O).
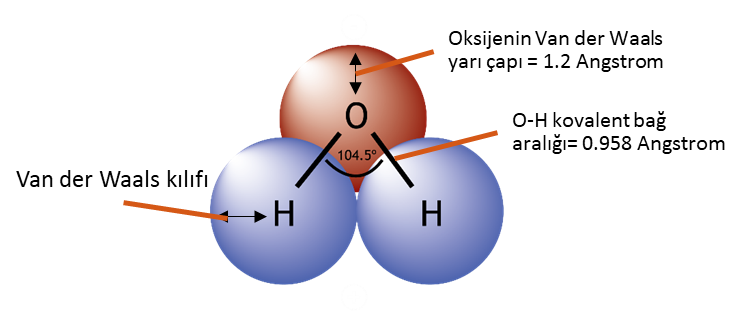
Temelde atomları ve molekülleri bir arada tutan kuvvettir (force). Bir molekül oluşturmak üzere atomları bir arada tutan kuvvete intra-moleküler yani molekül içi kuvvet denir. Birden fazla sayıda molekülü bir arada tutan kuvvete de inter-moleküler yani moleküller arası kuvvet adı verilir. Her iki kuvvet türü de maddelerin kimyasal ve fiziksel özelliklerini belirler.
Intra- ve inter-moleküler kuvvetler arasındaki temel fark, inter-moleküllerin kuvvetlerin moleküllerin kendi aralarında bulunması, intra-molekülerllerin ise bir molekül içindeki atomlar arasında bulunmasıdır.
| Bir molekül içindeki atomları bir arada tutan kuvvettlerdir. | Molekülleri bir maddede tutan kuvvetlerdir. |
| İnter-moleküler kuvvetlerden daha güçlüdürler. | İntra-moleküler kuvvetlerden zayıftır. |
| Kimyasal bağladır. | Çekim kuvvetleridir. |
| Bir maddenin imyasal özelliklerini belirler. | Maddenin halini (sıvı, katı, gaz, plazma) ve fiziksel özelliklerini belirler (erime ve kaynama noktası gibi). |
| İyonik, Kovalent ve Metalik Bağlar olarak sınıflandırılır. | Hidrojen Bağları, van der Waals Kuvvetleri (London Dispersiyon (dağılım) Kuvvetleri ve Dipol-Dipol Etkileşimleri), İyon-Dipol Etkileşimleri, Hidrofobik etkileşimler |
İntra-Moleküler Kuvvetler: Kimyasal Bağlar
İntra-moleküler kuvvetler kimyasal bağların oluşumundan sorumludur. Molekül içi etkileşimler, iki atom elektron paylaştığında veya başka bir atoma/atomdan elektron bağışladığında/kazandığında meydana gelir. Kısaca bir atomun başka bir atomdan elektron kazanması veya başka bir atoma elektron bağışlaması ile oluşan bağa iyonik bağ, elektronların iki atom arasında paylaşılması ile oluşan bağa kovalent bağ denir. İntra-moleküler kuvvetler, bir maddenin kimyasal özelliklerini belirler. İyonik bağda atomlar elektronları birbirine aktarır. İyonik bağlar, en az bir elektron vericisi (donör) ve bir elektron alıcısı (akzeptör) gerektirir. Tersine, aynı elektronegatifliğe sahip atomlar, kovalent bağlar yaparak elektronları paylaşırlar, çünkü atomlardan hiçbiri paylaşılan elektronları tercihli olarak çekmez veya itmez. Metalik bağlar da bir tür intra-moleküler bağlar olarak sınıflandırılır.
İyonik Bağlar
Bir veya daha fazla sayıda elektronun, bir atomdan tamamen ayrılıp, diğer bir atoma geçmesi sonucu oluşan pozitif ve negatif yüklü iyonlar arasındaki elektrostatik çekim gücünden ileri gelen bağlanmaya elektrovalent bağlanma veya iyonik bağlanma adı verilir.

İyonik bağda, elektronlar bir atomdan diğerine aktarılır ve bu da pozitif ve negatif iyonların oluşumuna neden olur. Pozitif ve negatif iyonlar arasındaki elektrostatik çekimler, bileşiği bir arada tutar. İyonik bağ, değerlik elektron(lar)ının atomlar arasında tam transferidir ve iki zıt yüklü iyon üreten bir kimyasal bağ türüdür. En dıştaki yörüngesinde az sayıda elektron bulunan metaller nedeniyle gözlenir. Bu elektronları kaybederek, bu metaller soy gaz konfigürasyonu elde edebilir ve oktet kuralını karşılayabilir. Benzer şekilde, değerlik kabuğunda 8’e yakın elektrona sahip ametaller, soy gaz konfigürasyonunu elde etmek için elektronları kolayca kabul etme eğilimindedir.
Bilgi Notu
Oktet Kuralı (Sekizli Kural): Soygazların (18A) elektron dizilimine sahip olmayan atomlar, buna ulaşmak için tepkime verirler. Elementlerin bileşik meydana getirirken, son yörüngelerindeki elektron sayılarını, soy gazlarınkine benzer kılmak için, sekize getirmesi kaidesidir.

İki atom yan yana geldiklerinde elektronlar her iki atomun çekirdek ve elektronlarının etkisi altına girerler. Bu karşılıklı etkileşimler sonunda Oktet kuralına uygun olarak elektronlar yeniden düzenlenir. Oktet kuralı iyon oluşumunu gerçekleştirici güç olarak tanımlanır. Elektron taşınması olayı elektron transferi olarak isimlendirilir. Sodyum (Na) elektron vericisi (donör) olarak görev yaparken, klor (Cl) atomu elektron alıcısı’ dır (akzeptör). Elektron dönoru ve alıcısı ne kadar güçlü ise elektron transferi o kadar kolay gerçekleşir. Akseptör niteliğinin ölçüsünü elektronegativitenin büyüklüğü belirler. Elektronegativite ne kadar küçükse, element de o derece yüksek donör niteliğine sahiptir. Bu nedenle periyodik tablonun solunda yer alan metaller ile sağında yer alan metal olmayanlar arasında elektronegativite farklılığı çok yüksektir ve iyonik reaksiyon kolay gerçekleşir.
İyonlar elektrostatik’in temel kurallarına göre iki aşamada birbirilerini çekerler. İlk aşama katyon ve anyon oluşumudur. Reaksiyon formülünde de görüldüğü üzere iyon bağları arasında çok büyük elektronegativite farkı bulunan atomlar arasında oluşur. Bağın oluşum gücü elektrostatik yapıdadır ve katı formda tipik olarak kristal yapı oluşturur.
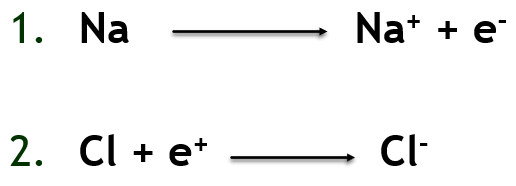
İyonlar elektrostatik’in temel kurallarına göre iki aşamada birbirilerini çekerler. İlk aşama katyon ve anyon oluşumudur.
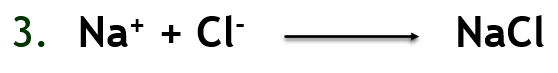
Reaksiyon formülünde de görüldüğü üzere iyon bağları arasında çok büyük elektronegativite farkı bulunan atomlar arasında oluşur. Bağın oluşum gücü elektrostatik yapıdadır ve katı formda tipik olarak kristal yapı oluşturur.
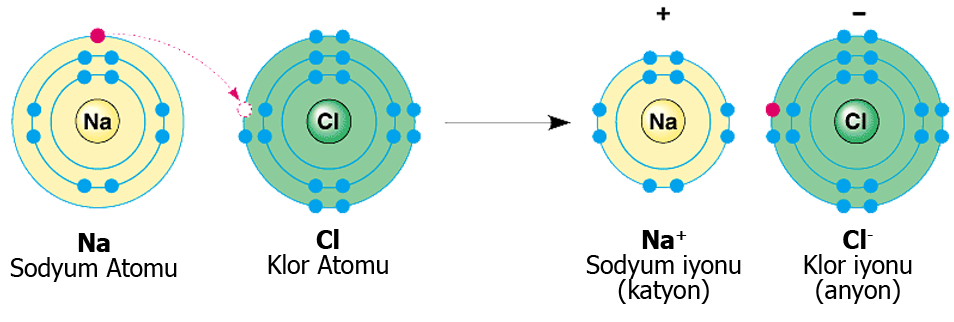
İyonik bağlarda e– aktarılması vardır. e– kaybeden atom pozitif iyon (katyon), e– alan atom ise negatif iyondur (anyon). İyonik bağı oluşturan atomlar arasında elektronegatiflik farkı büyüktür (fark > 2). İyonik karakter yüzdesi %50 üzeridir.
Medikal açıdan önemli bazı iyonlar
| Formül | İsmi | Formül | İsmi |
|---|---|---|---|
| Na+ | Sodyum iyonu | Cl– | Klorür |
| K+ | Potasyum iyonu | F– | Florür |
| Ca2+ | Kalsiyum iyonu | I– | İyodür |
| Mg2+ | Magnezyum iyonu | S2- | Sülfid iyonu |
| H+ | Hidrojen iyonu | SO42- | Sülfat iyonu |
| Cu2+ | Bakır iyonu | PO43- | Fosfat iyonu (orthophosphate) |
| Fe2+ | Demir (II) iyonu (Ferrik) | HCO3– | Bikarbonat (Hidroksidodioksidokarbonat) |
| Fe3+ | Demir (III) iyonu (Ferröz) | HO– | Hidroksid iyonu (oksidanit) |
| NH4+ | Amonyum iyonu |
Kovalent Bağlar
Elektronların her iki atom tarafından da ortaklaşa kullanılmasıyla oluşan bağlara kovalent bağ adı verilmektedir. Diğer bir deyişle; elektron çiftinin ortaklaşa kullanılmasıyla şekillenir. Bu tür bir bağ, aynı elementin iki atomu arasında veya periyodik tablodaki birbirine yakın elementlerin arasında meydana gelir. Bu bağ öncelikle ametaller arasında oluşur; ancak ametaller ve metaller arasında da gözlenebilir.
Bilgi Notu
Atomların benzer elektronegatiflikleri varsa (elektronlar için aynı afinite), kovalent bağların oluşması en olasıdır. Her iki atom da elektronlar için aynı afiniteye sahip olduğundan ve onları verme eğiliminde olmadığından, oktet konfigürasyonu elde etmek ve daha kararlı hale gelmek için elektronları paylaşırlar. Ayrıca iyonik bağın meydana gelmesi için atomun iyonlaşma enerjisi çok büyük ve atomun elektron afinitesi çok küçüktür.
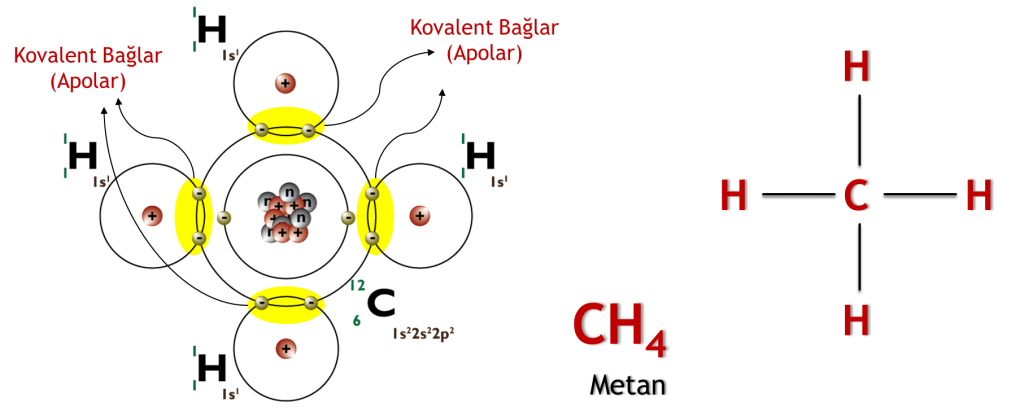
Karbon (C), bir oktetin yarısı olan 4 değerlik elektronuna sahip olduğu için iyonik bağ oluşturmaz. İyonik bağlar oluşturmak için karbon moleküllerinin 4 elektron kazanması veya kaybetmesi gereklidir. Bu son derece elverişsizdir; bu nedenle, karbon molekülleri 4 değerlik elektronunu tek, çift ve üçlü bağlar yoluyla paylaşır, böylece her atom soy gaz konfigürasyonları elde edebilir. Kovalent bağlar, sigma ve pi orbitallerinin etkileşimlerini içerir; bu nedenle kovalent bağlar tekli, ikili, üçlü ve dörtlü bağların oluşumuna yol açar.
Bu da karbonun canlılık için önemini açıkları. C atomu bu sayede başka C atomları ile uzun zincirler halinde bağlanabilme yeteneğine sahiptir. Bu özel niteliği C-Kimyası yada Organik Kimya olarak tanınlanmaktadır. C-Kimyası dışında kalanlar inorganik kimya olarak isimlendirilir. C zincir oluşumunun sınırı yoktur. Dolayısı ile organik kimyadaki molekül sayısıda sınırsızdır. C’lu bileşikler canlılık ve organizmadaki molekül çeşitliliği için çok önemlidir.
Kovalent bağlar Polar ve Apolar olmak üzere ikiye ayrılır.
Polar Kovalant Bağ: Elektronegatiflikleri farklı iki atom kovalent bağ meydana getirdiklerinde elektronları iki atom arasında eşit paylaşılmaz. Elektronegatifliği daha fazla olan atomun çekim gücü daha fazladır, dolayısı ile elektron çiftini daha fazla kendisine çeker ve polar kovalent bağ meydana gelir. Sonuç olarak, paylaşılan elektronlar, daha yüksek elektronegatifliğe sahip atoma daha yakın olacak ve bu da onu eşit olmayan bir şekilde paylaşacaktır. Bir polar kovalent bağ, molekülün biraz pozitif (daha düşük elektronegatifliğe sahip atomu içeren taraf) ve hafif negatif (yüksek elektronegatifliğe sahip atomu içeren taraf) sahip olmasına neden olur, çünkü paylaşılan elektronlar atoma doğru yer değiştirir. Bu nedenle polar kovalent bağların bir sonucu olarak, oluşan kovalent bileşik bir elektrostatik potansiyele sahip olacaktır. Bu potansiyel, ortaya çıkan molekülü hafifçe polar hale getirerek diğer polar moleküllerle zayıf bağlar (intermoleküler etkileşimler) oluşturmasına izin verir.
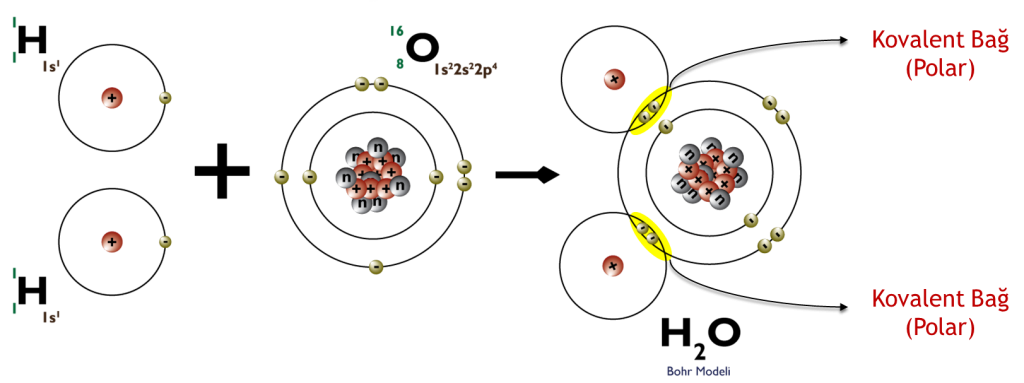
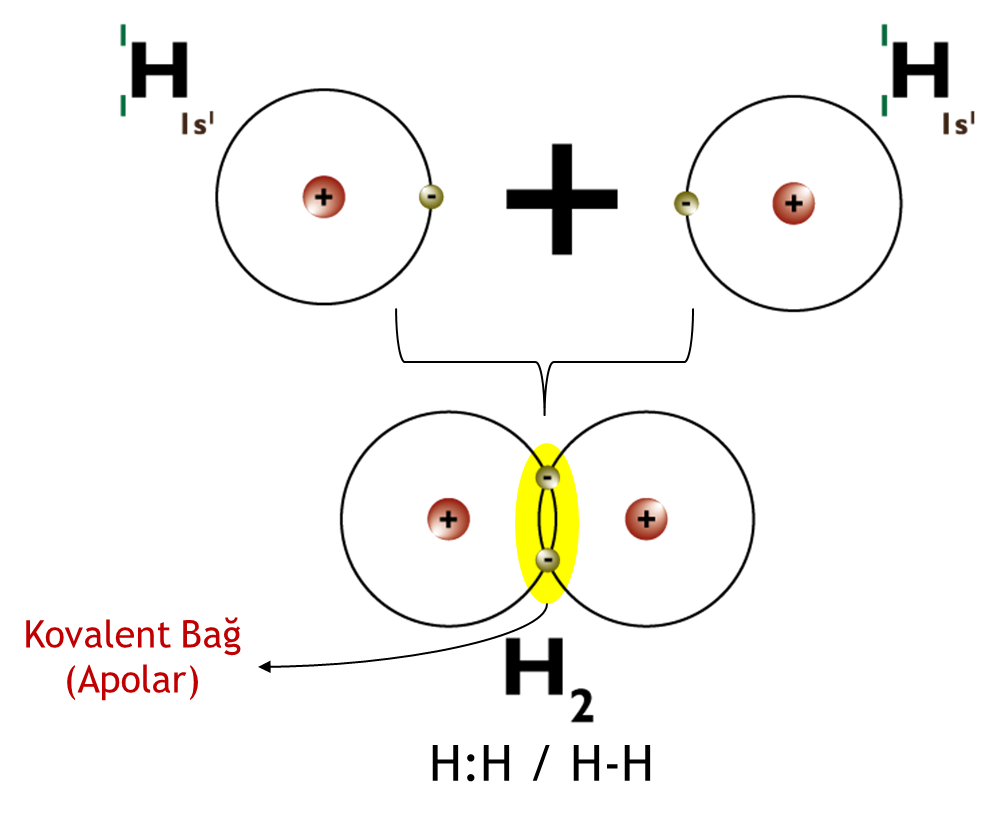
Apolar (Non-polar) Kovalent Bağ: Elektronegatifliği eşit ya da birbirine çok yakın değerde olan atomların oluşturduğu kovalent bağlardır. Her iki atom elektronlarını aynı ya da yaklaşık aynı ölçüde çeker. Atomlar elektronlarını eşit olarak paylaşır. Bu genellikle iki atom benzer veya aynı elektron afinitesine sahip olduğunda ortaya çıkar. Elektron afinitelerinin değerleri ne kadar yakınsa, çekim o kadar güçlü olur. Bu, gaz moleküllerinde meydana gelir; iki atomlu elementler olarak da bilinir. Ör. Hidrojen gazı atomu, Azot gazı atomları.
Bilgi Notu
Eğer kovalent bağ oluşurken elektron çifti aynı atom tarafından sağlanıyorsa bu şekilde oluşan kovalent bağa koordine kovalent bağ/datif bağ/dipolar bağ/koordine bağ denir.
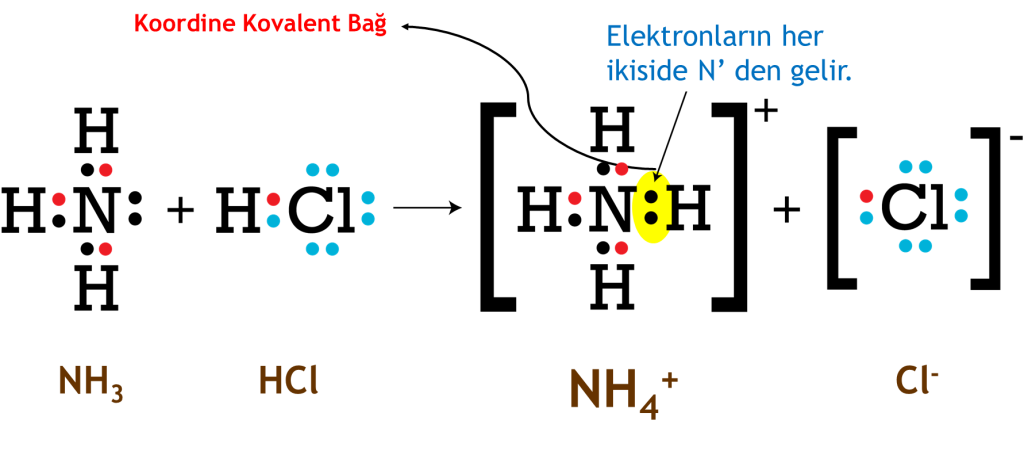
İyonik vs Kovalent Bileşikler
| Bir metal ile bir non-metal arasında olur. Zıt yüklü iyonlara (katyon ve anyon) sahip iki atom arasında elektrostatik çekim sonucu oluşan kimyasal bağdır. Bir metal ile bir non-metal arasında olur. | İki non-metal arasında elektron çiftlerinin atomlar arası ve diğer kovalent bağlarla paylaşılması ile şekillenen kimyasal bağdır. |
| Non-metal iyonlar, metal iyonlara göre daha güçlüdür. Böylece metalden kolayca elektronunu alır. İki karşıt iyon birbirini çeker ve iyonik bağ oluşur. | Benzer elektronegativiteli iki non-metal arasında olur. Birbirinden elektron transfer edemezler. En dış orbitteki elektronlarını paylaşırlar. |
| Elektron orbitalleri ayrıdır. | Elektron orbitalleri örtüşür. |
| Pozitif ve negatif şarjlar var. | Şarj yoktur. |
| Yüksek polarite vardır. | Polarite düşüktür. |
| Güçlü kimyasal bağlardır.* | Zayıf kimyasal bağlardır.* |
| İsimlendirmede Yunan harfleri önek olarak kullanılır. | Romen rakamları ile isimlendirilir. |
| Oda sıcaklığında katıdırlar. | Oda sıcaklığında katı, sıvı veya gaz olabilirler. |
| Sert veya kırılgandırlar (inorganik bileşikler). | Nispeten yumuşaktırlar (organik bileşikler). |
| Elektriksel olarak reaktiftirler. | Normalde elektriği iletmezler. |
| Erime ve kaynama noktaları yüksektir. | Erime ve kaynama noktaları düşüktür. |
| Partiküller arasında yüksek çekim vardır. | Moleküller arasında zayıf çekim vardır. |
Metalik Bağlar
Metal atomları arasında oluşan etkileşime metal bağı adı verilir. İyonlaşma enerjisi azaldıkça (period numarası arttıkça) metalik bağlar zayıflar. Değerlik elektronları sayısı artıkça metalik bağ kuvveti artar. Metalik bağ, kovalent bağ ve iyonik bağ ile birlikte üç güçlü etkileşimden (bağ) biridir. Fiziksel bir etkileşimdir. Metallere fiziksel özelliklerini kazandırır. Dayanıklılık, termal ve elektriksel direnç ve iletkenlik, opaklık ve parıltı gibi.
İnter-Moleküler Kuvvetler/Etkileşimler
Molekülleri bir arada tutan kuvvetlere genellikle inter-moleküler/moleküller arası kuvvetler/etkileşimler denir. Molekülleri birbirinden ayırmak veya parçalamak için gereken enerji, tipik bir iyonik veya kovalent bağ enerjisinden çok daha küçüktür, ancak inter-moleküler kuvvetler, bir maddenin özelliklerini belirlemede önemli roller oynar. Bu kuvvetler, moleküllerin nasıl etkileşime girdiği ve biyolojik organizmaları ve hatta yaşamı nasıl oluşturduğu açısından özellikle önemlidir.
Hidrojen Bağları
Hidrojen bağları bir tip özel dipol-dipol çekimin oluştuğu inter-moleküler etkileşimlerdir. Güçlü elektronegatif bir atoma bağlı bir hidrojen atomu, yalnız bir elektron çifti olan başka bir elektronegatif atomun yakınında bulunduğu zaman oluşur. İnter-moleküler etkileşimlerin en güçlüsüdür ancak, iyonik ve kovalent bağlara göre zayıftır.
Hidrojen bağında, bir hidrojen atomu O, N ve F gibi üç elektronegatif atom arasındadır ve bunlardan birine kovalent bağ ile, diğerine ise elektrostatik çekim kuvveti ile bağlanmıştır. Bağı oluşturan üç atom düz bir doğrultuda ise oluşan hidrojen bağı en güçlü yapıdadır.
Proteinlerin ve nükleik asitlerin yapısının ortaya çıkması açısından Hidrojen bağları son derece önemlidir. Örneğin DNA’nın ünlü çift sarmalını oluşturan iplikleri hidrojen bağları ile bir arada tutulur veya amino asitler arasında oluşan hidrojen bağlar peptid zincirlerinin karakteristik moleküler şekillerini (özellikle sekonder yapıları) kazanması açısından önemlidir.
En güçlü hidrojen bağları arasında F…H–F, O…H–O, F…H–O, N…H–N, F…H–N ve O…H–N yer alır.
H2O , HF ve NH3 gibi belirli maddeler, maddenin özelliklerini (erime ve kaynamak noktası, çözünürlük) etkileyen hidrojen bağları oluşturur. OH ve NH2 grupları içeren diğer bileşikler de hidrojen bağları oluşturur. Alkoller, asitler, aminler ve amino asitler gibi birçok organik bileşiğin molekülleri bu grupları içerir ve bu nedenle hidrojen bağı biyolojik açıdan son derece önemlidir.
Önemli Biyomoleküllerde bulunan başlıca Hidrojen bağlar
 | Su molekülleri arasında |
 | Su molekülü ile diğer moleküller arasında |
 | Protein ve nükleik asit yapılarında çok önemli |
 | Protein ve nükleik asit yapılarında çok önemli |
 | Protein ve nükleik asit yapılarında çok önemli |
 | Protein ve nükleik asit yapılarında çok önemli |
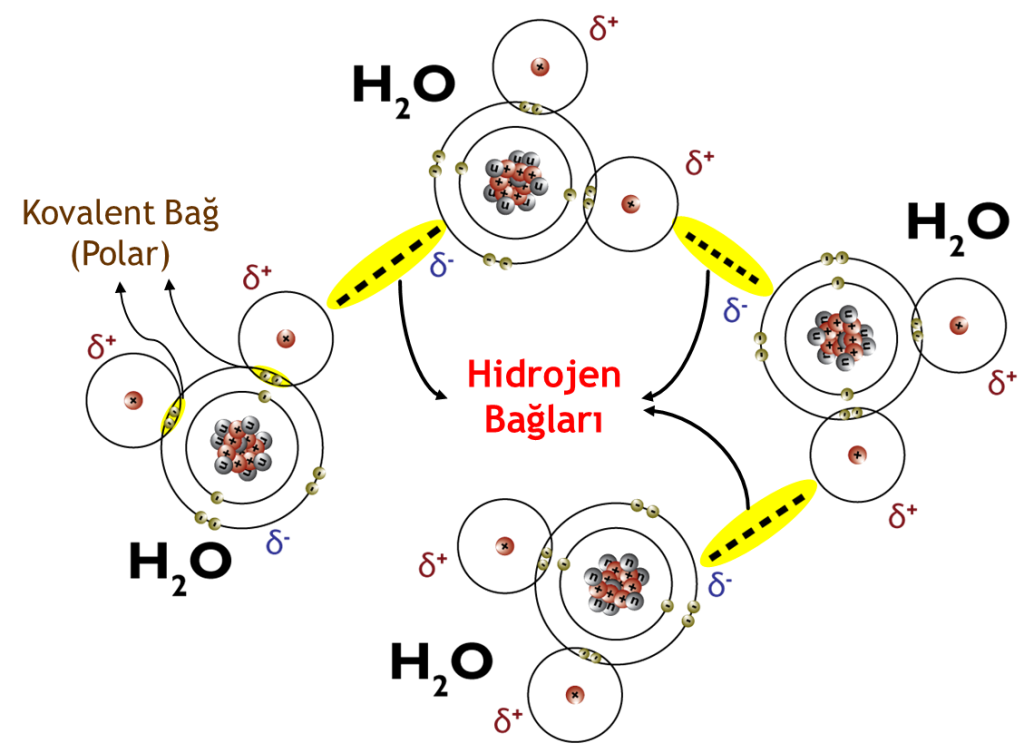
Hidrojen bağları bileşiklerin erime ve kaynama noktalarının yükselmelerine sebep oldukları gibi, protein ve nükleik asit gibi büyük moleküllü maddelerin molekül yapılarının oluşmasında çok önemli rol oynarlar. Çünkü hidrojen bağları yalnız moleküller arasında değil, molekül içinde de oluşabilir.
Hidrojen bağları, bir ilacın bileşimi ve vücutta nasıl etkileşeceği açısından da önemlidir. Spesifik olarak, eğer bir ilaç belirli bir hedef molekül üzerinde etki yapıyorsa, işlevini değiştirmek için moleküle bir şekilde bağlanmalıdır. Bu bağlanma hidrojen bağları rol oynar. Hidrojen bağları enzim-substrat etkileşimlerinde de kilit rol oynar.
Su molekülleri arasında hidrojen bağları olmaksızın yeryüzünde canlı yaşam mümkün değildir. Su molekküleri arasında kurulan hidrojen bağlarının kazandırdığı fiziksel özellikler hayat için vazgeçilmezdir. Hidrojen bağları sayesinde suyun kaynama noktası ve buharlaşma ısısı yükselir.
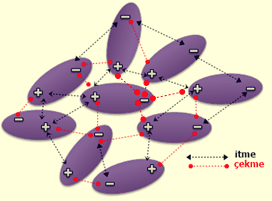
van der Waals Kuvvetleri/Etkileşimleri
Van der Waals kuvvetleri, moleküller arasındaki inter-moleküler kuvvetlerin çekimini tanımlamak için kullanılan genel bir terimdir. Van der Waals kuvvetleri, inter-moleküler kuvvetler arasındaki en zayıf etkileşimlerdir. Bununla birlikte, iki madde arasında etkileşen çok sayıda Van der Waals kuvvetiyle, etkileşim çok güçlü olabilir ki bu durum biyomoleküllerde önemlidir
İki tür Van der Waals kuvveti vardır: zayıf London Dispersiyon Kuvvetleri ve daha güçlü dipol-dipol kuvvetleri/etkileşimleri.
İyonlar, dipoller ve uyarılmış dipoller arasındaki etkileşimler, moleküllerin birçok özelliğinden sorumludur; buhar halindeki ideal gaz davranışından sapmalar ve gazların sıvı veya katı hallere yoğunlaşması gibi. Genel olarak, daha güçlü etkileşimler, katı ve sıvı hallerin daha yüksek sıcaklıklarda kalmasına izin verir. Bununla birlikte, apolar moleküller, basit elektrostatik çekim olarak tanımlayamayacağımız intermoleküler etkileşimler gösterirler. Bu etkileşimlere genel olarak dispersiyon kuvvetleri denir.
Elektronların eşit olmayan paylaşımı, kısa ömürlü dipoller oluşturan elektron bulutunun hızlı kutuplaşmasına ve aynı zamanda karşı kutuplaşmasına neden olur. Bu dipol, daha fazla dipol oluşturan komşu moleküllerin elektron bulutlarıyla etkileşime girer. Bu dipolün çekici etkileşimine London Dispersiyon kuvvetleri denir.

Moleküller arası gözlenen yük etkileşimi olarak tanımlanabilir.
Bu kuvvetler diğer moleküller arası kuvvetlerden daha zayıftır. Belirli bir molekül içindeki bu etkileşimlerin gücü, doğrudan moleküllerdeki elektronların ne kadar kolay hareket edebildiğine (yani polarize olabildiğine) bağlıdır. Elektronların çekirdekten uzak olduğu büyük moleküllerin polarize edilmesi nispeten kolaydır ve bu nedenle daha fazla dispersiyona sahiptir.
Dipol-dipol kuvvetleri, iki dipolar molekül uzayda birbirleriyle etkileştiğinde ortaya çıkar. London Dispersiyon kuvvetlerine benzer, ancak kalıcı olarak polar olan moleküllerde ve anlık olarak polar olan moleküllerde meydana gelirler. Moleküllerin zıt kutupları arasında oluşan elektrostatik çekim kuvvetidir. Bu meydana geldiğinde, polar moleküllerden birinin kısmen negatif kısmı, ikinci polar molekülün kısmen pozitif kısmına çekilir.
Bilgi Notu
Johannes Diderik van der Waals
(23 Kasım 1837 – 8 Mart 1923)
Hollandalı teorik fizikçi ve termodinamikçiydi. Van der Waals, gazlar ve sıvılar için hal denklemi üzerine yaptığı çalışmayla 1910 Nobel Fizik Ödülü’nü kazandı. Kariyerinin çoğunu, ilk Fizik Profesörü olduğu Amsterdam Üniversitesi’nde geçirdi.
(7 Mart 1900 – 30 Mart 1954)
Alman fizikçi ve profesördü. Kimyasal bağ ve moleküller arası kuvvetler (London dispersiyon kuvvetleri) teorilerine yaptığı temel katkıları ön plana çıkar. Süperiletkenlerin elektromanyetik özelliklerinin anlaşılmasına önemli katkılarda bulundu ve beş kez Nobel Kimya Ödülü’ne aday gösterildi.


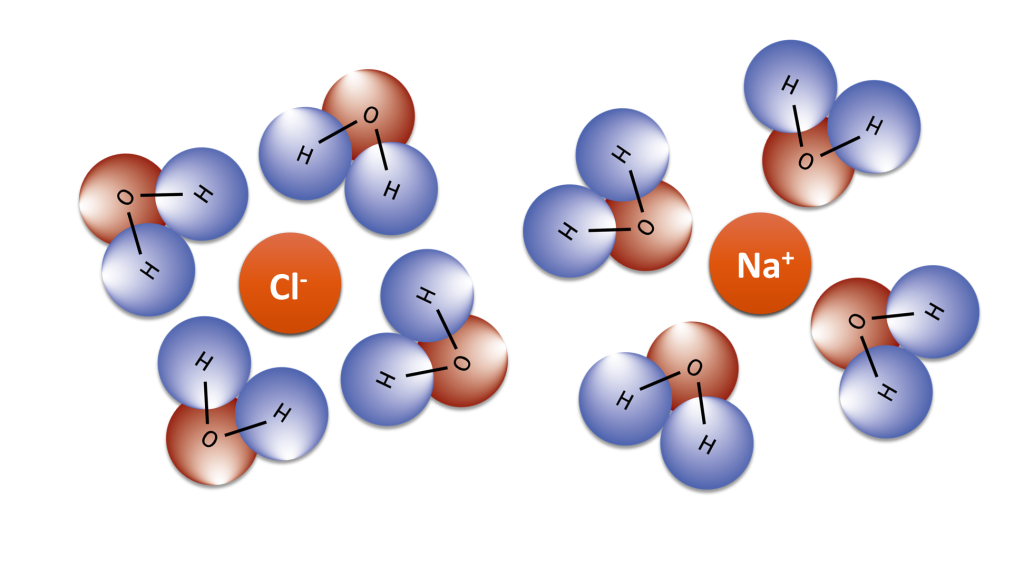
İyon-Dipol Etkileşimleri
Bir iyon-dipol kuvveti, bir iyon ile dipole sahip nötr bir molekül arasındaki elektrostatik çekimden kaynaklanan çekici bir kuvvettir. En yaygın olarak çözeltilerde karşımıza çıkar. Polar sıvılarda iyonik bileşiklerin çözeltileri için özellikle önemlidir. Pozitif bir iyon (katyon), nötr bir polar molekülün kısmen negatif ucunu çeker. Negatif bir iyon (anyon), nötr bir polar molekülün kısmen pozitif ucunu çeker. İyon-dipol etkileşim, iyon üzerindeki yük arttıkça veya polar molekülün dipolünün büyüklüğü arttıkça daha da güçlenir.
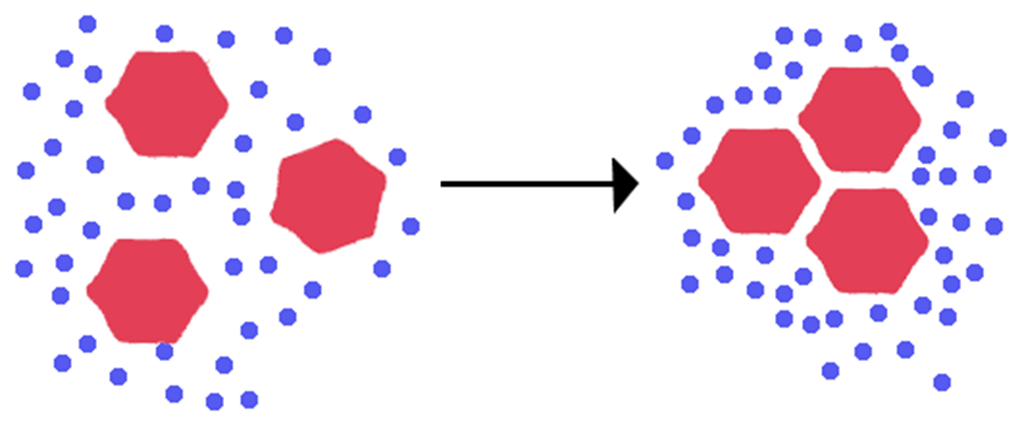
Hidrofobik Etkileşim
Hidrofobik etkileşimler, su ve hidrofobik (suyu sevmeyen) moleküller arasındaki ilişkileri tanımlar. Hidrofobik moleküller apolar moleküllerdir ve genellikle su molekülleri ile etkileşime girmeyen uzun bir karbon zincirine sahiptirler. Yağ ve suyun karıştırılması, bu özel etkileşimin iyi bir örneğidir. Yaygın yanılgı, hem su hem de yağ moleküllerine etki eden Van der Waals kuvvetleri çok zayıf olduğu için su ve yağın karışmamasıdır. Ancak durum böyle değildir. Bir yağ damlacığının sudaki davranışı, moleküller arası kuvvetlerden çok reaksiyonun entalpisi ve entropisi ile ilgilidir.
Yağ molekülleri gibi polar olmayan maddeler, su ortamında bir araya toplanma eğilimindedir. Böylelikle yağ moleküllerinin suyla minimum düzeyde temas etmesi sağlanır.
Hidrofobik etkileşimler, diğer zayıf intermoleküler kuvvetlerden nispeten daha güçlüdür ve bu durum çeşitli faktörlere bağlıdır.
- Sıcaklık: Sıcaklık arttıkça hidrofobik etkileşimlerin gücü de artar. Bununla birlikte, aşırı bir sıcaklıkta hidrofobik etkileşimler denatüre olacaktır.
- Hidrofobik maddelerdeki karbon sayısı: En fazla sayıda karbona sahip moleküller, en güçlü hidrofobik etkileşimlere sahip olacaktır.
- Hidrofobik maddelerin şekli: Alifatik organik moleküller, aromatik bileşiklerden daha güçlü etkileşimlere sahiptir. Bir karbon zincirindeki dallar, o molekülün hidrofobik etkisini azaltacaktır ve lineer karbon zinciri en büyük hidrofobik etkileşimi üretebilir. Bunun nedeni karbon dallarının sterik engel oluşturmasıdır, bu nedenle su ile temaslarını en aza indirmek için iki hidrofobun birbiriyle çok yakın etkileşime sahip olması daha zordur.
Hidrofobik etkileşimler proteinlerin katlanması açısından son derece önemlidir. Bir proteini stabil ve biyolojik olarak aktif tutmada rol oynar. Bu etkileşim ile proteinin yüzey alanı ve su ile istenmeyen etkileşimleri azaltılır. Proteinlerin yanı sıra, vücudumuzun her bir hücresinin hayatta kalması ve işlevleri için hidrofobik etkileşimlerin önemli rol oynadığı birçok başka biyolojik madde vardır. Örneğin fosfolipitler gibi.
Son Düzenleme: 29 Eylül 2023




